某些共价键的键能数据如下(单位:kJ/mol)
| 共价键 |
H-H |
Cl-Cl |
Br-Br |
H-Cl |
H-I |
I-I |
N≡N |
H-O |
H-N |
| 键能 |
436 |
247 |
193 |
431 |
299 |
151 |
946 |
463 |
391 |
(1)把1molCl2分解为气态原子时,需要 (填“吸收”或“放出”) kJ能量。
(2)由表中所列化学键所形成的分子中,最稳定的是 ,最不稳定的是 。
(3)由键能数据计算可以算出反应3H2(g)+N2(g)=2NH3(g)的反应热△H=__________。
(1)某气态氧化物的化学式为XO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为 。
(2)同温同压下,同质量的SO2与He的体积之比为 。
(3)设NA为阿伏加德罗常数的值,若a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的体积为 L.(用NA、a、b、c的代数式表示)
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造。
(1)粉红色、不溶于水的Co(OH)2具有两性,其溶于盐酸的离子方程式为_ ,Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3,反应的化学方程式为______________________。
(2)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为_ 。
②两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。由图中信息可知:_ 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果较好的是_ 。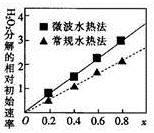
(3) CoCl2常用作多彩水泥的添加剂,可用钴的氧化物(其中Co的化合价为+2、+3)制备,用480 mL 5 mol·L-1盐酸恰好将其完全溶解,得到CoCl2溶液和6.72 L(标准状况下)黄绿色气体。则该钴的氧化物的化学式为_ 。
二氧化锗一般由四氯化锗水解制得,被广泛用于制作高纯金属锗、化工催化剂及电子器件等。现以含锗烟尘(主要含GeO2、SiO2和ZnO)为原料可制备GeO2,其工艺流程图如下:
已知;GeO2是两性氧化物;GeCl4易水解,沸点为86.6 ℃。
(1)第①步滤渣的主要成分有_ (填化学式),第④步操作所需的玻璃仪器为锥形瓶、牛角管、温度计、酒精灯、冷凝管和_ 。
(2)第③步萃取时,锗的萃取率与 (水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的
(水相和有机相的体积比)的关系如图所示,从生产成本角度考虑,较适宜的 的值为_ 。
的值为_ 。
(3)第④步加入盐酸的作用_ (答两点即可)。
(4)第⑤步反应的化学方程式是_ 。
(5)检验GeO2·nH2O是否洗涤干净的操作是_
氮及其化合物在生产、生活中有极其重要的作用。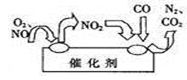
(1)我国长征系列运载火箭用肼(N2H4)作燃料。N2H4与NH3有相似的化学性质。
①写出肼与盐酸反应的离子方程式:____________。
②在火箭推进器中装有液态肼和双氧水,当它们混合时迅速反应生成氮气和水蒸气,写出反应的化学方程式:_ 。
③火箭发射时以肼为燃料,也可以用一氧化氮作氧化剂,反应过程中若转移2 mol电子,则消耗燃料肼的质量为_ 。
(2)汽车尾气中的氮氧化物是形成酸雨、酸雾的有毒气体之一,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。写出写出净化过程中总反应的化学方程式:_ 。
2015年8月12日天津港的爆炸事故中,有700 t氰化钠放在现场。NaCN为白色结晶颗粒(或粉末),熔点为563.7℃,沸点为1496℃,易溶于水,易水解,有剧毒。
回答下列问题:
(1)含NaCN的废液______________(填“能”或“不能”)直接排放。
(2)常温下,氰化钠能与双氧水反应,生成小苏打和某种碱性气体,大大降低其毒性,写出其反应的化学方程式:____ 。该反应中氧化剂的电子________________。
(3)常见合成氰化钠的反应有以下三步:
|
①2Na + 2M ="===" 2NaNH2 + H2
|
②2NaNH2 + C="====" Q+ 2H2↑
③Q+ C ="====" 2NaCN