Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4) Q、R、X、Y四种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)R的氢化物的熔沸点比同主族其它元素氢化物的熔沸点高,原因是R氢化物________
________________________________________________________________________。
(6)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。 (7)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
(7)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
A、B、C、D、E是中学化学常见的分子或离子,它们核外都有10个电子,且A是由5个原子核组成的粒子。它们之间可发生如下变化:A+B===C+D;B+E===2D,且D与大多数酸性氧化物及碱性氧化物均能反应。
(1)A的电子式:____________B的电子式:____________
(2)E的化学式为:__________
(3)用电子式表示D的形成过程:
(4)实验室制取C的方程式:
向10ml0.1mol/l的Na[Al(OH)4]溶液中滴加0.1mol/l的HCl溶液,生成沉淀的量与加入的盐酸体积的关系如图
(1)写出OA段的离子方程式
(2)写出AB段的化学方程式
(3)OB段反应共消耗ml盐酸溶液;
此过程中生成沉淀最多时,沉淀物质的量是mol,此时消耗的盐酸是ml
(10分)⑴键线式 表示的分子式;名称是。
表示的分子式;名称是。
⑵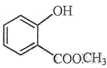 中含有的官能团的名称为
中含有的官能团的名称为
⑶丁基的4个结构简式为________________________________________________________
⑷含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_______ __、_________、尾接管、锥形瓶
写出支链上共含有3个C原子,主链上含碳原子数最少的烯烃的结构简式。
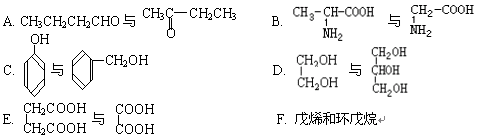
下列各化合物中,属于同系物的是,属于同分异构体的是(填入编号)