常温下,下列各组离子在溶液中一定能大量共存的是
| A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl一、SO42一 |
| B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3一 |
C.pH=12的溶液: 、 、 、 、 、Br- 、Br- |
D.由水电离产生的 的溶液: 的溶液: 、 、 、 、 、 、 |
下列有关SiO2的叙述正确的是
| A.SiO2不与任何酸反应 |
| B.玻璃中含有SiO2,所以不能用玻璃瓶盛装稀氢氧化钠溶液 |
| C.SiO2是酸性氧化物,能与NaOH反应 |
| D.SiO2能与水反应生成硅酸 |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.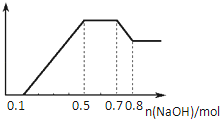
则下列说法正确的是
| A.溶液中一定不含CO32﹣,可能含有SO42﹣和NO3﹣ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+):n(Al3+):n(Mg2+)=1:1:1 |
下列说法不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
| A.①④ | B.①④⑤ | C.①②③④ | D.①②③④⑤ |
下列离子方程式正确的是
| A.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Cl﹣+2Fe3+ |
| B.大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O |
| D.为了除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理:Ca2++CO32﹣═CaCO3↓ |
图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O,对实验现象的“解释或结论”正确的是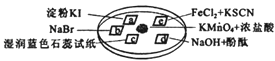
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl﹣ |