下列描述中,不符合生产实际的是( )
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 | B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饮和食盐水制烧碱,用涂镍碳钢网作阴极 | D.在镀件上电镀锌,用锌作阳极 |
已知反应:①101kPa时,C(s)+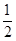 O2(g)═CO(g)△H1=-110.5kJ/mol
O2(g)═CO(g)△H1=-110.5kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ/mol,下列说中正确的是()
A.若碳的燃烧热用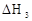 表示,则△H3<△H1 表示,则△H3<△H1 |
B.若碳的燃烧热用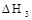 表示,则△H3>△H1 表示,则△H3>△H1 |
C.浓硫酸与稀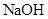 溶液反应的中和热值为57.3kJ·mol-1 溶液反应的中和热值为57.3kJ·mol-1 |
D.稀醋酸与稀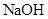 溶液反应生成1mol水,放出57.3kJ的热量 溶液反应生成1mol水,放出57.3kJ的热量 |
与我国的“神舟六号”采用液态燃料作推进剂不同,美国的航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑ ΔH<0,下列对此反应的叙述 错误的是( )
| A.上述反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵只起氧化剂作用 |
下列事实不能用勒夏特列原理来解释的是()
| A.高压有利于氢气与氮气合成氨 |
| B.实验室中常用排饱和食盐水的方法收集Cl2 |
| C.用V2O5催化二氧化硫氧化为三氧化硫 |
| D.Cl2在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
据报道,某国一集团拟在太空建造巨大的激光装置,把太阳光变成激光用于分解海水制氢:2H2O 2H2↑+O2↑,下列说法正确的是( )
2H2↑+O2↑,下列说法正确的是( )
①水的分解反应是放热反应
②氢气是一级能源
③使用氢气作燃料有助于控制温室效应
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可以改善生存环境
| A.①② | B.②③ | C.①③ | D.③④ |
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是
| A.H2 | B.Cl2 | C.NaH | D.HF |