同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究。
上述两种物质发生反应的化学方程式为 ,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸。
[实验探究]
㈠确定废液中是否含有盐酸
⑴选择试剂:根据盐酸的化学性质,同学们选用了如下图所示的五种物质,物质x是酸碱指示剂中的 溶液。
⑵实验验证:某同学向废液中加入少量的镁粉,观察到 ,确定废液中一定没有盐酸。
㈡确定废液中是否含有Na2CO3
某同学选用 测出废液的pH=l0,确定废液中一定含有Na2CO3。
你还可以选择 或 ,确定废液中一定含有Na2CO3。
㈢处理废液,回收利用
欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
| 方案 |
加入试剂 |
分离方法 |
方案评价 |
| 1 |
适量Ca(NO3)2溶液 |
过滤、蒸发结晶 |
不可行,理由是 |
| 2 |
过量的 |
蒸发结晶 |
可行 |
2022年12月,天津经东营到滩坊的高铁将开工建设。高铁建设中铝合金、不锈钢、高锰钢等金属材料必不可少。
(1)铝合金制造的高铁车体,具有提高运行速度、能抗击强大气流的冲击和耐受雨雪侵蚀等特点。这是利用了铝合金的 等优点。
(2)请写出工业上以赤铁矿为原料炼铁的化学方程式: 。
(3)向 和 的混合溶液中加入一定量铁粉,待充分反应后过滤,向滤渣中加入稀盐酸。
①有气泡产生,则滤渣中一定有 (填化学式,下同);
②若没有气泡产生,滤液中一定有的溶质是 。
如图为碳酸钠和碳酸氢钠两种物质的溶解度曲线,请回答下列问题:

(1)30℃时, 的溶解度是 g。
(2)40℃时,向两只各盛有100g水的烧杯中,分别加入 、 固体,至不再溶解为止,所得溶液的溶质质量分数大的是 溶液。
(3)将40℃时等质量的 和 的饱和溶液同时降温到10℃,析出晶体较少的是 溶液。
(4)A、B两点分别表示 的两种溶液,要使B点的溶液变为A点的溶液,可采取措施是 。
(5)小英同学说,常温下,她配制了一瓶溶质质量分数为16.4%的 饱和溶液,请判断小英同学的说法是否正确, (填“是”或“否”)。
(1)黄河水经沉降、吸附、杀菌消毒等净化过程可得到自来水,自来水属于 (填“混合物”或“纯净物”)。
(2)饮用硬度过大的水不利于人体健康,生活中常用 检验水是硬水还是软水。
(3)如图是电解水的实验装置图,连接正负两极的玻璃管内产生的气体体积比为 ,检验a管中产生的气体方法是 。

(4)北京冬奥会“飞扬”火炬使用氢气作为燃料,体现了绿色奥运理念。氢气作为绿色燃料的优点是 。
(5)如图是两种变化的微观图示:

①②两种变化中属于物理变化的是 (填“①”或“②”),从微观角度看,物质发生化学变化的实质是 。
上世纪50年代,我国在A市探明铁矿藏(主要成分 )储量巨大。为将铁矿石变成钢铁,国家建设冶炼工厂,运入大量煤炭,用作冶炼钢铁原料、火力发电和生活燃料。源源不断的钢铁从这里运出支持国家建设,但是随着持续大量使用煤炭,生态环境也日趋脆弱,甚至恶化。
进入新时代,A市政府秉持“绿水青山就是金山银山”的发展理念,落实“碳达峰、碳中和”的发展目标,重新审视发展模式。A市地处高原,每年刮风和日照时间较长;附近拥有数条河流和许多湖泊,水资源比较丰富。于是A市政府确定,围绕钢铁工业,大力发展“绿色”电能,用电生产氢气,用氢气取代煤炭,走“绿色低碳”经济发展道路。
结合上述材料回答下列问题:
(1)将煤隔绝空气加强热可得到焦炭,焦炭能够用于冶炼铁,说明焦炭具有 性。
(2)根据地方资源特色,A市规划发展“绿色”电能,首先应当重点将 (写一种)转化为电能;然后利用电生产氢气。利用电生产氢气的化学方程式是 。
(3)氢气的化学性质和一氧化碳有许多相似之处。写出用氢气与氧化铁在高温条件下反应,冶炼铁的化学方程式 。A市将氢气用于冶炼钢铁和生活燃料,所排放的废弃产物都是 ,对环境影响很小。
化工工艺流程一般为:原料→预处理→核心反应→分离提纯→目标产物。某铝业集团利用铝土矿(主要成分 ,杂质不溶于水也不参与反应)冶炼金属铝的流程如下图所示:
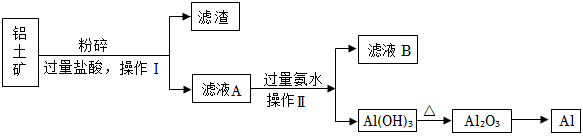
查阅资料:①氨水( )为弱碱,可沉淀溶液中的 、 、 等离子
②溶液中 遇强碱会发生分步反应【以 溶液和 溶液为例】:
回答下列问题:
(1)原料预处理过程中将矿石粉碎的目的是 。
(2)操作I、Ⅱ的名称是 。
(3)滤液A中的溶质是 (写化学式)。
(4)补充该流程核心反应的化学方程式: 。
(5)此工艺流程中不能用“过量 溶液”代替“过量氨水”的原因是 (文字表述)。