下表是元素周期表的一部分,请回答有关问题:
IA ⅡA ⅢA ⅣA VA ⅥA ⅦA 0
1 a b
2 c d e f g
3 h i j k l
4 m n
(1)a元素与d元素形成的化合物的电子式:_____________________;
(2)用电子式表示mn化合物的形成过程_________________________;
(3)属于稀有气体的是__________(填元素符号,下同);
(4)将等物质的量的k元素的单质通入FeBr2溶液中,发生反应的离子方程式是:___________________________,该反应的氧化剂是:__ _____________(写物质名称);
(5)表中能形成两性氢氧化物的元素是_______,写出其氢氧化物与h的氢氧化物的水溶液反应的离子方程式____________________________________________;
某校化学兴趣小组为研究Cl2单质的性质,设计如下图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是。
(2)加入药品前,检查I中气体发生装置气密性的操作是:____________________。
(3)装置Ⅱ的作用是。
(4)实验过程中,装置IV中的实验现象为___________________________________;发生反应的化学方程式为。
(5)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在_________之间还需添加洗气瓶(选填装置序号),该装置的作用是______________________。
(6)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式。
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 7N2+12H2O
7N2+12H2O
①上述反应中被还原的元素是(填元素符号),反应中每转移2.4mol电子,生成N2的物质的量为。
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3 O+O2
O+O2
Ⅱ、NO+O3 →NO2+O2
Ⅲ、 NO2+O→NO+O2
上述反应中NO所起的作用是;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
| 方法Ⅰ |
用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,写出该反应的离子方程式:,是利用了SO2的性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性D.酸性氧化物
(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:甲醇脱水反应①2CH3OH(g) = CH3OCH3(g)+H2O(g)D△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g) = C2H4 (g)+2H2O(g)D△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g) = CH3OCH3(g))D△H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g) C2H5OH(g) △H=;
C2H5OH(g) △H=;
(2)乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图。结合曲线归纳平衡转化率-T曲线变化规律: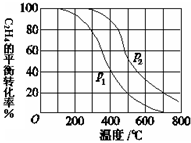
(a);
(b);
(3)若要进一步提高乙烯的转化率,可以采取的措施有。
A.增大乙烯的浓度 B.分离出乙醇 C.加催化剂
(4)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,求x的值。(写出计算步骤)
(10分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: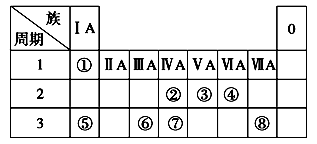
(1)画出⑧原子结构示意图__________ __;
(2)④、⑤、⑥的简单离子半径由大到小的顺序是________。(用离子符号表示)
(3)①-⑧的元素中,某元素气态氢化物与其最高价氧化物对应的水化物反应所得生成物溶于水,溶液呈酸性,原因是____ _ _(用离子方程式表示),该氢化物分子空间结构为______ _;
(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式_。
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知: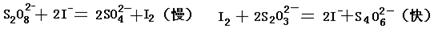
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: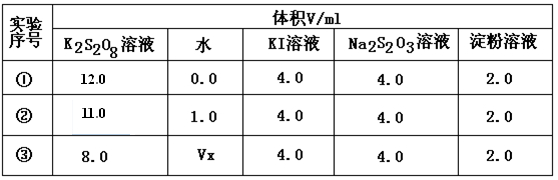
表中Vx=mL,理由是。
已知某条件下,浓度c(S2O82—)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)~t的变化曲线示意图(进行相应的标注)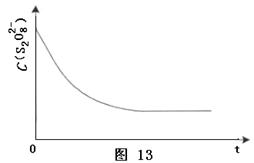
碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)="2LiI" (s)△H
已知:4Li(s)+O2(g)=2Li2O(s)△H1
4 LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则电池反应的△H=_______________