A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是: ___________________ _ _______________(用化学式表示);写出C与A形成的18e-化合物的电子式 ;
(3)用电子式表示A2C的形成过程: 。
(4)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:__________________________;写出题中生成M的化学方程式 。
0.3 mol的氧气和0.2 mol的臭氧(O3),(1)它们的质量比,
(2)它们所含的分子数比,
(3)它们所含的原子数比,
(4)它们同温同压时的体积比是。
根据下列几种粒子的结构示意图,回答问题:(填元素符号或离子符号)
(1)其中属于阴离子的是,
(2)属于金属元素的是,
(3)具有相似化学性质的是.
人们认识原子结构经历了古典原子论、近代原子论、模型、模型和现代原子论等几个阶段。
有FeCl3和AlCl3的混合溶液100ml,向其中加入过量的NaOH溶液,充分反应后,过滤,干燥,共生成沉淀10.7g。
(1)写出混合溶液中加入过量NaOH溶液的离子方程式、;
(2)将10.7g沉淀加热灼烧,最后得到固体克;
(3)FeCl3的物质的量的浓度是mol/L;
(4)在加入NaOH溶液的过程中,生成沉淀的质量与加入NaOH溶液的体积如下图所示,计算AlCl3的物质的量的浓度mol/L;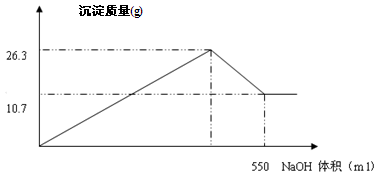
(5)求NaOH溶液的物质的量浓度?(提示:请写出第(5)小题的解题过程)
在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)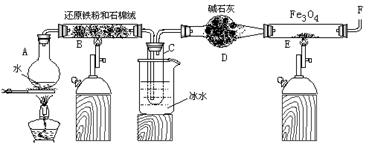
(1)烧瓶A中常加入碎瓷片,其作用是,B中石棉绒的作用,小试管C的作用是。
(2)反应开始时先点燃处(填A或B)酒精灯,为了安全,在E管中的反应发生前,在F出口处必须,E管中的反应开始后,在F出口处应。
(3)写出高温下Fe 与H2O(g)反应的化学方程式,在一定条件下该反应实际上是可逆反应,试用化学平衡移动原理加以解释本实验中是如何实现Fe向Fe3O4的转变的。
(4)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象____________________________________________________。