(13分)某校化学兴趣小组对课本实验结论“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了相关探究。
[一]提出猜想,请你完成猜想2、3。
猜想1、红色沉淀可能是Cu;
猜想2、 ;
猜想3、 。
[二]查阅资料:①Cu20属于碱性氧化物②Cu+在酸I生条件下能发生自身氧化还原反应
[三]制备红色沉淀:①制备氢氧化铜悬浊液②氢氧化铜悬浊液与葡萄糖共热③过滤、洗涤、低温烘干得红色粉末
[四]红色沉淀成分探究:该小组同学设计了三种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
方案Ⅲ:装置如图所示:(夹持仪器略去)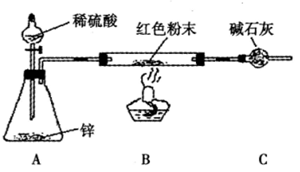
试回答下列问题:
(1)请分别评价方案I和方案Ⅱ是否合理(填“是”或“否”),并完成相关反应方程式:
方案I: ,写出Cu20与稀硝酸反应的化学方程式 ;
方案Ⅱ: ,写出反应的离子方程式 。
(2)实际上,方案Ⅲ的装置尚存在明显的缺陷,应在A和B之问添加 。
(3)方案Ⅲ中,探究小组的同学在锥形瓶中加入少量硫酸铜溶液,其目的是 。
(4)方案Ⅲ中,若要测定红色粉末的成分,需要测定下列哪些物理量 (填序号)。
①反应前红色粉末与硬质玻璃管的总质量 ②实验前干燥管的质量 ③实验后干
燥管的质量 ④硬质玻璃管的质量 ⑤锌粒质量 ⑥稀硫酸的物质的量浓度
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、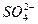 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下: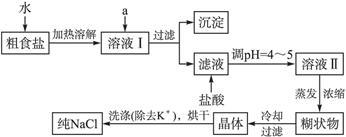
提供的试剂:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、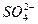 离子,选出a所代表的试剂,按滴加顺序依次为______________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为______________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有______________(填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2_______(填“>”“=”或“<”)2 L,原因是______________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为______________。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置: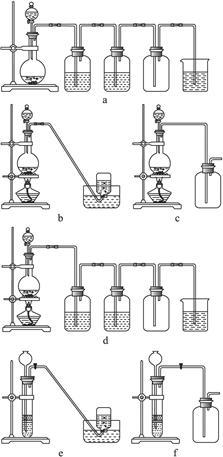
某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。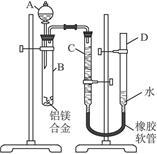
(1)A中试剂为__________________________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性,上述操作的顺序是________________;(填序号)记录C的液面位置时,除视线平视外,还应___________。
(4)B中发生反应的化学方程式为________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________________________________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将__________(填“偏大”“偏小”或“不受影响”)。
已知甲和I、L、M均为常见的单质,I在常温下为气体,L、M为金属;气体K的水溶液显碱性;A是由前20号元素组成的阴阳离子个数比为1∶1的离子化合物,且阴离子含有14个电子;乙是一种红棕色的粉末,G为白色胶状沉淀,D在常温下是无色液体,C的溶液常用于在实验室检验E。各物质之间的转化关系如下图所示(部分物质在图中没有列出)。
请根据要求填空:
(1)A的化学式为______________________,E的电子式为_______________________。
(2)反应①的化学方程式为___________________________________________________。
(3)反应②的化学方程式为___________________________________________________。
(4)J→G的离子方程式为_____________________________________________________。
在阿富汗战争和伊拉克战争中美军士兵佩带的头盔、防弹背心和刚性前后防护板能够有效防御子弹和炮弹碎片,它们在战争中保住了许多美军士兵的生命。新型纤维不久将有望取代使用了数十年的凯夫拉纤维,成为未来防弹装备的主要制造材料。M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,下面是M5纤维的合成路线(部分反应未注明条件):
已知:当反应条件为光照且与X2反应时,通常是X2与烷或苯环侧链烃基上的H原子发生的取代反应,而当反应条件为催化剂存在且与X2反应时,通常为苯环上的H原子直接被取代。根据上述合成M5纤维的过程,回答下列问题:
(1)合成M5的单体G的结构简式为_______________,F的含氧官能团的名称有___________。
(2)在①~⑦的反应中,不属于取代反应的是___________,②的反应条件是______________。
(3)生成A的同时可能生成的A的同分异构体为_________________________________。
(4)1 mol的C和足量新制的氢氧化铜悬浊液反应可以生成___________mol砖红色沉淀。
(5)1 mol的F和Na2CO3溶液反应最多消耗Na2CO3___________mol。
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是;乙的作用是。
(3)反应进行一段时间后,干燥试管
中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管
中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_。要除去该物质,可先在混合液中加入(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过(填实验操作名称)即可除去。