下列各组离子在指定条件下一定能大量共存的是
| A.无色溶液中:K+、Na+、MnO4‑、SO42‑ |
| B.pH为13的溶液:CO32‑、SO32‑、[Al(OH)4]-、Na+ |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3‑、Br-、Ba2+ |
| D.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- |
下列图示与对应的叙述不相符的是
| A.图1表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲线 |
| D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,体积V与沉淀n的变化 |
下列有关金属腐蚀与防护的说法正确的是
| A.金属的电化腐蚀和化学腐蚀本质相同,但电化腐蚀伴有电流产生 |
| B.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈 |
| C.钢铁发生析氢腐蚀时,正极发生的电极反应为:Fe-2e-®Fe2+ |
| D.埋在地下的钢管与电源正极连接可以减缓腐蚀 |
某同学按右图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是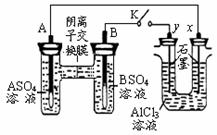
A.金属活动性A强于B
B.B电极反应B-2e-=B2+
C.x电极上有H2产生,发生还原反应
D.反应初期x电极周围出现白色沉淀,继续实验沉淀将溶解
恒温恒容的三个密闭容器,N2(g)+3H2(g) 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
| 容器 编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
A.放出热量a<b<92.4
B.三个容器内反应的平衡常数③>①>②
C.N2的转化率①<②
D.达平衡时氨气的体积分数①>③
下列说法不正确的是
| A.乙醇、乙醛、乙酸都能与H2O形成分子间氢键 |
| B.丙烯中最多有7个原子共平面 |
| C.乙醇与金属钠反应比水与金属钠反应更剧烈,羟基H活性更高 |
D.乙酸、甲酸甲酯和羟基乙醛(如图)互为同分异构体 |