某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_____ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果______(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_________________________________;判断到达滴定终点的依据是:______________________________________________________________。
(4)以下是实验数据记录表
| 滴定次数 |
盐酸体积(mL) |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.04 |
| 3 |
20.00 |
0.20 |
16.28 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,
其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为: ________mol·L-1
X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是: ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路” b.插入电极通直流电后,有一极附近液体颜色加深 c.向该液体中加入硝酸银溶液,无沉淀产生 d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2氧化放热98.0kJ,若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为: 。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
以下一些氧化物和单质之间可发生如右图所示的反应:其中,氧化物(Ⅰ)是红棕色固体,氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是 。氧化物(Ⅱ)的化学式(分子式)是 。
(2)反应①的化学方程式是 。反应②的化学方程式是 。反应③的化学方程式是 。
(7分)化工行业已合成出一种硬度比金刚石还大的晶体——氮化碳。已知氮化碳中氮元素的化合价为-3,则:
(1)它的化学式是 。
(2)其晶体属于 晶体。
(3)你认为其硬度比金刚石大的主要原因是 。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图___________。
(2)由以上元素形成的金属单质中,熔点最低的是___________________。
(3)NH3·H2O的电离方程式为NH3·H2O
 +OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______________________。
+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______________________。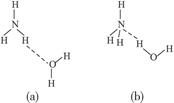
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________________________。(填写字母)
(5)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式:_____________________。
短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号______________;D的原子结构示意图______________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是_______________________。
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是______________(填写具体的化学式 )。
(4)CA2与D元素的单质在水溶液中反应的化学方程式是______________________________。