氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C 2AlN + 3CO↑
2AlN + 3CO↑
下列叙述不正确的是
| A.在氮化铝的合成反应中,N2是还原剂 |
| B.在氮化铝的合成反应中,C是还原剂 |
| C.氮化铝中氮元素的化合价为-3 |
| D.上述反应中每生成1molAlN,转移3 mol e- |
对于第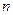 能层,若它作为原子的最外层,则容纳的电子数最多与
能层,若它作为原子的最外层,则容纳的电子数最多与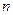 —1层相同,当它作为次外层,则其容纳的电子数比
—1层相同,当它作为次外层,则其容纳的电子数比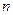 +1层上电子最多能多10个,则第
+1层上电子最多能多10个,则第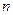 层为( )
层为( )
| A.L能层 | B.M能层 | C.N能层 | D.任意层 |
下列叙述中,不属于核外电子特点的是( )
| A.质量很小 | B.运动范围很小 |
| C.运动速率很快 | D.有确定的运动轨道 |
下列原子中电离能最大的是( )
| A.Be | B.C | C.Al | D.Si |
具有下列电子排布式的原子中,半径最大的是( )
| A.1s22s22p63s23p1 |
| B.1s22s22p5 |
| C.1s22s22p63s23p4 |
| D.1s22s22p1 |
下列有关原子结构的说法,正确的是( )
| A.稀有气体元素原子的最外层电子数都是8 |
| B.非金属元素的最外层电子数都大于3 |
| C.金属元素的最外层电子数都小于4 |
| D.氢原子的电子云是球形对称的 |