已知:①101 kPa时,C(s)+1/2O2(g)===CO(g) ΔH1=-110.5 kJ/mol;
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ/mol
下列结论正确的是
| A.若碳的燃烧热用ΔH3来表示,则ΔH3<ΔH1 |
| B.若碳的燃烧热用ΔH3来表示,则ΔH3>ΔH1 |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
x、y、z为三种气体,把a mol x和b mol y充入一密闭容器中,发生反应,x+2y 2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为
2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为
| A.(a+b)/5×100% | B.2(a+b)/5b×100% |
| C.2(a+b)/5×100% | D.(a+b)/5a×100% |
下列各组离子,在所给条件下能够大量共存的是
| A.pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42- |
| B.水电离出的c(H+)=10-8mol/L的溶液中,K+、HCO3-、Cl-、S2- |
| C.使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO42- |
D.在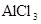 溶液中Na+、AlO2-、SO42-、NO3- 溶液中Na+、AlO2-、SO42-、NO3- |
下列操作会使H2O的电离平衡向电离方向移动且pH<7的是
| A.向水中加少量Na2CO3 |
| B.向水中加少量FeCl3 |
| C.向水中加少量NaHSO4 |
| D.向水中加入少量NaCl |
室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
| A.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 |
| B.0.1mol/L的硫酸和0.1mol/L的氢氧化钡溶液 |
| C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| D.pH=4的盐酸和pH=10的氨水 |
升高温度能加快化学反应速率的主要原因是
| A.增加活化分子百分数 | B.降低活化分子的能量 |
| C.活化分子能量明显增加 | D.降低反应所需的能量 |