已知700K时,N2+3H2  2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是( )
2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是( )
| A.Q = Q1 = 1/2Q2 | B.Q>Q1>2Q2 |
| C.Q>2Q2>Q1 | D.Q = Q1 = Q2 |
下列说法正确的是
| A.需加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件一定能发生反应 |
| C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 |
| D.当△H<0时表明反应为吸热反应 |
下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液HCO +OH- +OH- CO CO +H2O +H2O |
B.氯化铁溶液中通入硫化氢气体2Fe3++S2- 2Fe2++S↓ 2Fe2++S↓ |
C.次氯酸钙溶液中通入过量二氧化碳Ca2++2ClO-+H2O+CO2 CaCO3↓+2HClO CaCO3↓+2HClO |
D.FeCl3溶液中加入少量的HI溶液:2Fe3++2I- 2Fe2++I2 2Fe2++I2 |
有FeO、 Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻0.8 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol/L 的盐酸的体积为
| A.200mL | B.100mL | C.50mL | D.无法计算 |
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是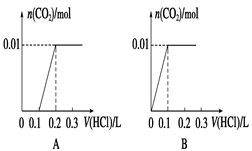
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原.现用25.00ml0.049mol/L羟胺的酸性溶液与足量硫酸铁溶液完全反应,生成的Fe2+恰好与24.50ml0.020mol/LKMnO4酸性溶液完全作用
【已知:2KMnO4+10FeSO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O】,则上述反应中羟胺的氧化产物是
| A.N2 | B.N2O | C.NO | D.NO2 |