一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
A.CO2(g) + 2NH3(g) CO(NH2)2(s) + H2O(g);△H<0 CO(NH2)2(s) + H2O(g);△H<0 |
B.CO2(g) + H2(g) CO(g) + H2O(g);△H>0 CO(g) + H2O(g);△H>0 |
C.CH3CH2OH (g) CH2=CH2(g) + H2O(g);△H>0 CH2=CH2(g) + H2O(g);△H>0 |
D.2C6H5CH2CH3(g) + O2(g) 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 2 C6H5CH=CH2(g) + 2H2O(g);△H<0 |
5.下列措施不合理的是
| A.用SO2漂白纸浆和草帽辫 | B.用硫酸清洗锅炉中的水垢 |
| C.高温下,用焦炭还原SiO2制取粗硅 | D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
4.利用下图所示装置进行下列实验,能得出相应实验结论的是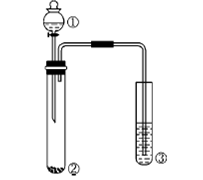
3.某溶液中可能含有OH-、CO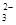 、AlO
、AlO 、SiO
、SiO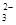 、SO
、SO 、Na+、Mg2+、Al3+八种离子中的几种。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积的变化如下图所示。由此可知原溶液中
、Na+、Mg2+、Al3+八种离子中的几种。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸的体积的变化如下图所示。由此可知原溶液中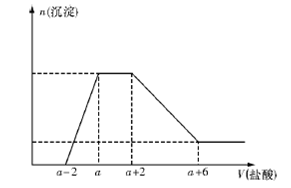
A.不含SO |
B.含有的阴离子一定是OH-、AlO 、SiO 、SiO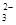 |
C.含有的阴离子一定是OH-、CO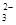 、AlO 、AlO 、SiO 、SiO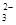 |
D.含有的AlO 与SiO 与SiO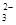 的物质的量之比为3:1 的物质的量之比为3:1 |
2.下列试剂中,不会因为空气中的氧气而变质的是
| A.亚硫酸钠 | B.漂白粉 | C.硫酸亚铁 | D.氢硫酸 |
1.下列说法错误的是
| A.浓氨水可用于检验氯气管道是否漏气 |
| B.明矾可用作除去污水中悬浮颗粒的絮凝剂 |
| C.Si用于制造光导纤维 |
| D.硬铝、青铜和不锈钢都属于合金 |