在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )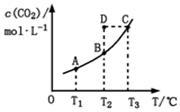
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的 ΔH>0 CO2(g)+H2(g)的 ΔH>0 |
| B.在T2时,若反应处于状态D,则一定有ν正<ν逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
下列解释实验事实的化学方程式或离子方程式不正确的是
A.氯气用于自来水的杀菌消毒:Cl2+H2O HCl+HClO HCl+HClO |
B.将“NO2球”浸泡在热水中,颜色变深:2NO2(g)  N2O4(g) N2O4(g)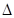 H<0 H<0 |
| C.向Ba(OH)2溶液中滴加NaHSO4溶液,至溶液呈中性:OH-+ Ba2++ H++SO42- = BaSO4↓+ H2O |
| D.铜片溶解在KNO3和稀硫酸的混合液中:3Cu + 8H+ + 2NO3- === 3Cu2+ + 2NO↑ + 4H2O |
NA为阿伏伽德罗常数的值,下列叙述不正确的是
| A.常温常压下,8gO2含有4 NA个电子 |
| B.0.5mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
C.14g分子式为CnH2n的链烃中含有的碳碳双键的数目为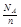 |
| D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有OH-的数目为0.2NA |
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种。下列说法不正确的是
出发合成BHT的方法有如下两种。下列说法不正确的是
| A.推测BHT在水中的溶解度小于苯酚 |
B.BHT与 都能使酸性KMnO4退色 都能使酸性KMnO4退色 |
| C.方法一和方法二的反应类型都是加成反应 |
D.BHT与 具有完全相同的官能团 具有完全相同的官能团 |
已知Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒属于一个氧化还原反应中的反应物和生成物。下列叙述中不正确的是
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.Fe3+和Fe2+分别属于反应物和生成物 |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e- = Fe3+ |
甲、乙、丙三种不同物质的转化关系: 则甲不可能是
则甲不可能是
| A.Al2O3 | B.SiO2 | C.NH4Cl | D.CO2 |