A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2:1、1︰1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
(1)D与F形成D2F的电子式为______________;A、C、D三种元素组成的化合物含有化学键的类型是________________;
(2)由E、F两种元素组成的化合物1 mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为___________ mol。
(3)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为_________________________________ 。
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
A.达到平衡所需要的时间:Ⅰ>Ⅱ B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
右图是元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。回答下列问题:
⑴请在右图中将过渡元素所在的位置“用斜线”画出。
⑵R的第一电离能A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式;
⑶R的氢化物在A的氢化物中溶解度极大,原因是;
A的氢化物比B的氢化物热稳定性强,原因是。
⑷图中A、B两元素形成的离子 中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
⑸第三周期8种元素按单质熔点(℃)高低的顺序如右图,(已知序号“1”代表Ar),其中序号 “8”代表(填元素符号);其中电负性最大的是(填下图中的序号)。
⑹C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
_______________________________________________________________
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是(填元素符号或化 学式,下同);第一电离能从大到小的顺序是
学式,下同);第一电离能从大到小的顺序是
(2)C原子的电子排布图 _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式__,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为杂化,空间构型为__。
(4) C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为。
根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
(1)在周期表中,最可能处于同一族的是___________
A.Q和R B.E和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是____________
A. B.R+ C.T3+D.
B.R+ C.T3+D.
(3)下列元素中,化学性质和物理性质最像Q元素的是____________
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是_______区元素,其氯化物的化学式为___________________
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外________________________________________________。
(6)如果R、E、T是同周期的三种主族元素,其中元素_______的第一电离能反常高的原因是_____________。
在元素周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则 。
。
据此请回答:
⑴锂在空气中燃烧,除了生成_______外,也生成微量的___________。
⑵铍的最高价氧化物对应水化物属于两性化合物,证明这一结论的有关离 子方程式_______________________________,______________________。
子方程式_______________________________,______________________。
⑶科学家证实,BeCl2是共价化合物,设计一个简单实验证明,其方法是
______________________________ ________________。用电子式表示BeCl2的形成过程____________________________________________
________________。用电子式表示BeCl2的形成过程____________________________________________
人们对苯及芳香烃的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6 的
一种含两个叁键且无支链链烃的结构简式。
(2)已知分子式为 C6H6 的结构有多种,其中的两种为
①这两种结构的区别表现在:
定性方面(即化学性质方 面):Ⅱ能(选填a、b、c、d,多选扣分)而Ⅰ不能。
面):Ⅱ能(选填a、b、c、d,多选扣分)而Ⅰ不能。
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6 与H2加成时:Ⅰ需mol,而Ⅱ需 mol。
mol。
②今发现C6H6还可能有另一种如右图立体结构:该结构的二氯代物有种。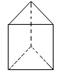
(3)萘也是一种芳香烃,它的分子式是 C10H8 ,请你判断,它的结构简式可能是下列中
C10H8 ,请你判断,它的结构简式可能是下列中
的(填入编号)。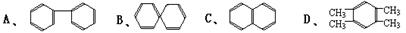
(4)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列事实(填
入编号)。
a.萘不能使溴水褪色 b.萘能与H2发生加成反应
c.萘分子中所有原子在同一平面上 d.一溴代萘(C10H7Br)只有两种
(5)现代化学认为萘分子碳碳之间的键是。