在一个体积为2L的容器中,充入4mol CO和4mol H2O, 一段时间后反应CO(g) + H2O(g)  CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为( )
CO2(g) + H2(g)在密闭容器中达到了平衡状态。平衡后[CO2]= 1.8mol·L-1,则该温度下此反应的平衡常数K为( )
| A.27 | B.36 | C.54 | D.81 |
有机化合物有不同的分类方法,下列说法正确的是()
①组成元素分:烃、烃的衍生物
②从分子中碳骨架形状分:链状有机化合物、环状有机化合物
③从官能团分:烯烃、炔烃、卤代烃、醇、酚、醛、酮、羧酸、酯等
| A.①③ | B.①② | C.②③ | D.①②③ |
盆烯的分子结构如图所示。关于盆烯的说法正确的是()
| A.盆烯的一氯取代物有5种 | B.盆烯能与氢气发生加成反应 |
| C.盆烯是苯的一种同分异构体 | D.盆烯是乙烯的一种同系物 |
下列的实验操作不能达到预期目的的是()
①在苯酚溶液中滴入少量稀溴水出现白色沉淀
②配制银氨溶液时,将2%氨水慢慢滴入2%硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
③将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色
④将苯和溴水混合后加入铁粉制取溴苯
⑤用乙醇和3%的硫酸共热到170℃制取乙烯
| A.①③④ | B.②③④ | C.①④⑤ | D.①②④⑤ |
下列说法正确的是()
| A.秸秆、毛发及塑料完全燃烧都只生成二氧化碳和水 |
| B.纤维素、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
| C.苯和乙烯都能使溴水褪色,均与溴发生加成反应 |
| D.蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 |
下列叙述正确的是( )
| A.用核磁共振氢谱鉴别1-丙醇和2-丙醇 |
B.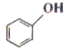 和 和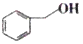 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 |
C. 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
| D.分子式为C3H6有机物最多存在4个C-C单键,与C5H12的碳碳单键数相同 |