某二元酸(化学式H2A)在水中的电离方程式是H2A→ H+ + HA-、HA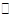 H++A2-又知0.1 mol/LNaHA溶液的pH = 2。则下列说法不正确的是…………………( )
H++A2-又知0.1 mol/LNaHA溶液的pH = 2。则下列说法不正确的是…………………( )
A、因为A2-+H2O 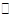 HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B、0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L
C、NaHA溶液中各种离子浓度的关系是c(Na+) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D、在NaHA溶液中,HA-电离的趋势大于其水解的趋势
下列反应能表明SiO2具有微弱氧化性的是()
| A.SiO2+2NaOH====Na2SiO3+H2O | B.SiO2+Na2CO3 Na2SiO3+CO2↑ Na2SiO3+CO2↑ |
C.SiO2+2C Si+2CO↑ Si+2CO↑ |
D.SiO2+4HF====SiF4↑+2H2O |
有四种物质:SiO2、HF、Na2CO3、NaOH,它们两两之间在一定条件下发生反应的数目是()
| A.3 | B.4 | C.5 | D.6 |
将一定量的碳与8 g氧气置于一密闭容器中,使之在高温下反应,当恢复至原温度时,容器内压强比原来增大0.4倍,则参加反应的碳的质量为()
| A.2.4 g | B.3 g | C.4.2 g | D.6 g |
2006年8月4日,青海格尔木一市民在昆仑山河道发现一块重约46吨的巨石,疑似玉石,实属罕见。经测定其化学成分为Mg3Ca2Al2Si8OxH2,则x的值为()
| A.22 | B.23 | C.24 | D.25 |
将下列反应所产生的气体,通入硅酸钠溶液中后不发生反应的是()
| A.CO2与Na2O2 | B.Cu与浓H2SO4共热 |
| C.Cu与浓硝酸共热 | D.食盐与浓H2SO4共热 |