(共6分)如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题: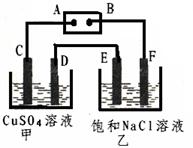
(1)电极A的名称是
(2)甲装置中电解反应的总化学方程式
是
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
(8分)现有以下物质:①NaCl晶体②SO3水溶液③CH3COOH④石墨
⑤BaSO4 固体⑥蔗糖溶液⑦酒精⑧熔融的KNO3⑨干冰。
请回答下列问题(用序号表示):
(1)以上物质中能导电的是(2)以上物质中属于电解质的是
(3)以上物质中属于非电解质的是(4)以上物质中属于弱电解质的是
(8分)在相同温度和相同压强状况下,相同体积的CO和CO2中,求以下数据:
(1)它们所含的氧原子数目之比为
(2)它们的质量之比为
(3)它们的密度之比为
(4)它们所含的电子数之比为
(10分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(此题两个空填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
某温度下,纯水中的c(H+)=2×10-7 mol/L,则此时c(OH-)=________。若温度不变,滴入稀H2SO4使c(H+)=5×10-6 mol/L,则c(OH-)=________,由水电离出的c(H+)为________。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为mol·L-1·s-1反应的平衡常数K1为。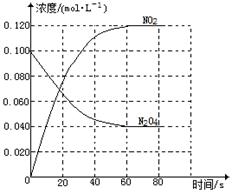
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是。
②列式计算温度T时反应的平衡常数K2。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是。