已知A、B、C、D、E、F是含有同一种元素的化合物,其中A为红棕色气体, F能使红色湿润石蕊试纸变蓝色。它们之间能发生如下反应:
① A+H2O → B+C ② C+F → D ③ D+NaOH 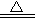 E+ F↑+H2O
E+ F↑+H2O
(1)写出它们的化学式:D ,F 。
(2)写出①反应的化学方程式: ,
此反应中氧化剂是 ,还原剂是 。
(3)写出反应③的离子方程式: 。
(4)工业生产C的过程中有如下一步反应:即F经催化氧化生成B和H2O,写出该步反应的化学方程式: 。
选考[化学——选修3:物质结构与性质] (15分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的第三能层的电子排布式,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为。
(2)PO43-的空间构型是。
(3)氨基乙酸铜的分子结构如图,氮原子的杂化方式为。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为。
(5)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为。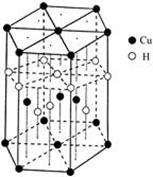
(6)铜晶体为面心立方最密堆积,铜的原子半径为r pm,则晶体铜密度的计算式为g/cm3。
选考[化学——选修2:化学与技术 ]( 15 分)
硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸。
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装(填设备名称)。吸收塔中填充有许多瓷管,其作用是。
(2)为使硫磺充分燃烧,经流量计1通人燃烧室的氧气过量50 % ,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计 1 和流量计 2 的空气体积比应为。 b 管排出的尾气的处理方法是。
(3)与使用硫铁矿为原料的生产工艺相比,该工艺的特点是。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加人适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式。
铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。回答下列问题。
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是________________。
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)______________________
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为 ______,该氧化物中的Fe分别为Fe2+、Fe3+,计算n(Fe2+):n(Fe3+)= _________
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4  Cu。
Cu。
若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是__________
| A.相等 | B.①多 | C.②多 | D.无法判断 |
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1________(填“大于”、“可能大于”、“等于”或“可能等于”)m2
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为_______mol
(14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图: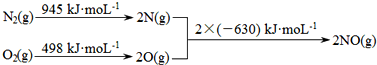
则该反应的热化学方程式为。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H= -b kJ•mol-1
CH3OH(g);△H= -b kJ•mol-1
①该反应的平衡常数表达式为。
②若容器容积不变,下列措施可增加甲醇产率的是。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1 mol CO和3 mol H2 |
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1,则此时v正v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置: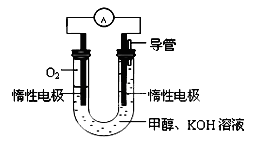
①工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
②用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为mol/L(假设电解前后溶液体积不变)。