25 °C和101 kPa时,乙烷、乙烯组成的混合气体50 mL与过量的氧气混合并完全燃烧,恢复到原来的温度和压强,气体的总体积缩小了105 mL,原混合烃中乙烷的体积分数
为
A. 15% B. 20% C,25% D. 30%
下列各图所表示的反应是吸热反应的是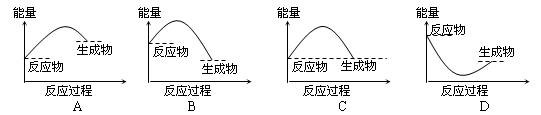
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,
放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.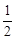 N2H4(g)+ N2H4(g)+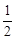 O2(g)==== O2(g)====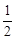 N2(g)+H2O(g);ΔH=+267 kJ·mol-1 N2(g)+H2O(g);ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)====N2(g)+2H2O(l);ΔH =-133.5 kJ·mol-1 |
把分别盛有熔融的氯化钾.氯化镁.氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾.镁.铝的物质的量之比为
| A.1︰2︰3 | B.3︰2︰1 | C.6︰3︰1 | D.6︰3︰2 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2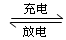 Cd+2NiOOH+2H2O,由此可知,该电池充电时的阴极材料是
Cd+2NiOOH+2H2O,由此可知,该电池充电时的阴极材料是
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiOOH |
下列描述中,不符合生产实际的是
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |