某元素原子的最外层电子数是次外层电子数的3倍,且最外层电子数与次外层电子数之和小于10。该元素为( )。
| A.锂 | B.铍 | C.氧 | D.钙 |
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则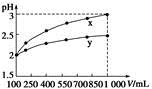
| A.x为弱酸,Vx<Vy | B.x为强酸,Vx>Vy |
| C.y为弱酸,Vx<Vy | D.y为强酸,Vx>Vy |
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
| A.A点时pH=1 |
| B.恰好完全沉淀时Ba(OH)2的体积为2 L |
C.B点时,溶液中的离子浓度关系为c(Na+)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| D.C点时pH=14 |
现有室温下的四种溶液,有关叙述不正确的是
| 编号 |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.相同体积的③、④溶液分别与NaOH完全反应,消耗NaOH的物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中:c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.Va L④溶液与Vb L②溶液混合[近似认为混合溶液体积=(Va+Vb)L],若混合后溶液的pH=4,则Va∶Vb=11∶9
在下列各组的比较中,前者比后者大的是
| A.25 ℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 |
| B.25 ℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 |
| C.同温度、同浓度的NaCl溶液和氨水的导电能力 |
| D.25 ℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度 |
下列关于电解质溶液的叙述正确的是
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(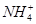 )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |