已知下列热化学方程式:
Zn(s)+O2(g)===ZnO(s) ΔH1=-351.1 kJ/mol
H2(l)+O2(g)===H2O(s) ΔH2=-90.7 kJ/mol
由此可知反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH3的值是( )
| A.-441.8 kJ/mol | B.-254.6 kJ/mol | C.-438.9 kJ/mol | D.-260.4 kJ•mol‾1 |
化学实验中有时需要将某些溶液或试剂进行酸化,下列酸化方法正确的是()
| A.检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,再加盐酸酸化 |
| B.提高KMnO4溶液的氧化能力:用盐酸将KMnO4溶液酸化 |
| C.鉴定溶液中是否有Fe2+:先将溶液用硝酸酸化,再加入KSCN溶液 |
| D.检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加入BaCl2溶液 |
下列实验过程中产生的现象与对应图形相符合的是()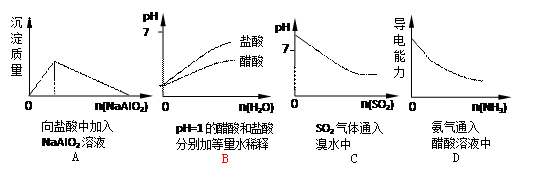
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关说法正确的是
| A.反应中NF3是氧化剂,H2O是还原剂() |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2mol HNO3,则反应共转移0.2mol e- |
| D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 |
下列各溶液中,有关成分的物质的量浓度关系正确的是()
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4溶液,(NH4)2Fe (SO4)2溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl)
在25℃时,AgX、AgY、AgZ均难溶于水,且Ksp(AgX) = 1.8×10-10,Ksp(AgY) = 1.0×10-12,Ksp(AgZ) = 8.7×10-17。下列说法(均在25℃)错误的是()
| A.三种饱和溶液中溶质的物质的量浓度的大小顺序为c(AgX)>c(AgY)>c(AgZ) |
| B.若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减少 |
| C.若取0.188g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为1.0×10-2mol·L-1 |
| D.往C选项的溶液中加入1 mL 0.1mol·L-1的NaZ溶液,能生成AgZ沉淀 |