如图所示,电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下表中说法正确的是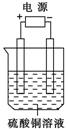
| |
电极材料 |
通电后的变化 |
|
| 阴极 |
阳极 |
||
| A |
石墨 |
石墨 |
阴极质量增加,溶液的pH增大 |
| B |
铜 |
铜 |
阳极质量减小,阴极质量增加 |
| C |
铁 |
铁 |
两极的质量不发生变化 |
| D |
铂 |
铁 |
阴极质量增加,溶液的浓度不变 |
下图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指()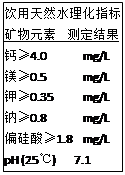
| A.原子 | B.分子 | C.单质 | D.元素 |
用NA表示阿伏加德罗常数,下列叙述正确的是()
| A.标准状况下,22.4L H2O含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.常温常压下,1 NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol / L的MgCl2溶液中,含有Cl-物质的量浓度为1 mol / L |
下列操作中不正确的是()
| A.过滤时,玻璃棒与三层滤纸的一边接触 |
| B.过滤时,漏斗下方紧贴烧杯内壁 |
| C.加热试管内物质时,试管底部与酒精灯灯芯接触 |
| D.向试管中滴加液体时,胶头滴管紧贴试管内壁 |
下列离子的检验方法中正确的是( )
A.某溶液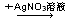 生成白色沉淀,说明原溶液中有Cl- 生成白色沉淀,说明原溶液中有Cl- |
B.某溶液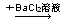 生成白色沉淀,说明原溶液中有SO42— 生成白色沉淀,说明原溶液中有SO42— |
C.某溶液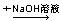 生成蓝色沉淀,说明原溶液中有Cu2+ 生成蓝色沉淀,说明原溶液中有Cu2+ |
D.某溶液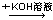 生成红褐色沉淀,说明原溶液中有Mg2+ 生成红褐色沉淀,说明原溶液中有Mg2+ |
为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后先后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
| A.K2CO3——Ba(NO3)2——KOH——HNO3 |
| B.Ba(NO3)2——KOH——HNO3——K2CO3 |
| C.KOH——K2CO3——Ba(NO3)2——HNO3 |
| D.Ba(NO3)2——KOH——K2CO3——HNO3 |