某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5 g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸吸收。测得吸收氨气的溶液总质量m与反应时间t的变化如下图所示。所涉及的反应为:
(NH4)2SO4+2NaOH===Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4 ="=" (NH4)2SO4。
请计算: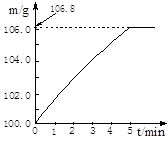
(1)完全反应后产生氨气 g。
(2)该化肥的含氮量为 (精确到0.1%),则这种化肥属于 (填:“合格”或“不合格”。合格硫酸铵含氮量为20%以上)产品。
(3)请计算废硫酸中硫酸的质量分数(写出计算过程)。
(4)若实验过程中氨气被完全吸收,但该实验测得硫酸铵化肥的含氮量高于实际值,其原因是 。
将氯化钠与碳酸钠的混合物15.0g,溶于100mL水中,向所得溶液中滴加5.55%的氯化钙溶液至完全反应,如图是所加氯化钙溶液与生成沉淀质量关系图,求恰好完全反应时:
(1)原混合物中,碳酸钠的质量.
(2)所得溶液中,溶质质量分数.(计算结果精确至0.1%)

取8.0g铝土矿(主要成分是Al 2O 3),溶于128.4g稀盐酸中,盐酸恰好完全反应.经过滤、干燥后,得到滤渣2.9g,(假定铝土矿样品中所含的杂质不溶于盐酸).
(1)求铝土矿的纯度 %.
(2)求所得溶液的溶质的质量分数(写出计算过程).
取25g某石灰石样品于一只烧杯中,并向烧杯中加入146g稀盐酸,恰好完全反应后测得烧杯内剩余物质的质量为162.2g,已知石灰石中的杂质不与稀盐酸发生反应
(1)反应中生成二氧化碳的质量为 ;
(2)计算所加稀盐酸中溶质质量分数.
某碳酸钾样品中混有少量氯化钾杂质,取一定量样品于烧杯中,向烧杯中加入100g质量分数为7.3%的稀盐酸,此时恰好完全反应,将所得溶液蒸干得到18.1g固体,计算样品中碳酸钾的质量分数?(计算结果精确到0.1%)
取10g氢氧化钠溶液于烧杯中,向其中加入10g溶质质量分数为9.8%的稀硫酸恰好完全反应。请计算:
反应后所得溶液的溶质质量分数。(计算结果精确到0.1%)