在0.1 mol/L氨水中,分别加入少量下列物质,溶液中的c(OH-)如何变化?(填“增大”、“减小”或“不变”)
⑴加少量HNO3溶液____________ ⑵加少量KOH溶液___________
⑶加少量(NH4)2SO4固体__________ (4)加大量水__________
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)A是,G是。(用化学式填写)
(2)H与盐酸反应生成E的化学方程式是。
(3)E与F反应的化学方程式是。
(4)F与G的水溶液的反应生成I和D的离子方程式是。
(5)向H溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,但该反应中没有放出E气体,则该反应的离子方程式。
(6)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:则物质I的物质的量为_______________mol。
某小组同学欲探究NH3催化氧化反应,按下图装置进行实验。
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2 
(1)NH3催化氧化的化学方程式是。
(2)装置B中产生气体的原因有(结合化学用语解释)。
(3)甲乙两同学分别按上述装置进行实验。一段时间后,装置G中溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是。
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:。
(4)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”)装置A中的产气量,或(填“增加”或“减少”)装置B中的产气量。
(5)为实现该反应,也可用下图所示的装置替换上述装置中虚线框部分,化合物X为。NH4HCO3的作用是。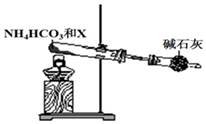
以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以此废渣制备铁红(Fe2O3)的过程如下。此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH见右表。
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是。
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出离子方程式:。
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出总反应的离子方程式:。
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为≤pH<。
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):。
有一透明溶液,已知其中可能含有Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、
HCO3-、SO42-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混和气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混和气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(1)淡黄色粉末的名称为;
(2)溶液中肯定有离子,肯定没有离子,可能有________离子;
(3)写出下列反应方程式
①淡黄色粉末与水反应;
②产生刺激性气味气体的离子方程式;
③加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失,反应的离子方程式为;
(4)溶液中阳离子的物质的量之比为(H+及没有确定的离子除外)。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、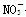 、
、 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br-B. C.CH3COO-D.
C.CH3COO-D.
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是____________________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______________。