分类法在化学学科的发展中起到了非常重要的作用,下列分类标准不合理的是
| A.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| B.根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
| C.根据是否含氧元素,将物质分为氧化剂和还原剂 |
| D.根据水溶液或熔融状态是否能够导电,将化合物分为电解质和非电解质 |
下列关于有机化合物的认识不正确的是
| A.油脂在空气中完全燃烧转化为水和二氧化碳 |
| B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
| C.石油的分馏和煤的干馏都属于化学变化 |
| D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
【改编】下列说法正确的是
| A.电解饱和食盐水可制取烧碱、氯气、氢气 |
| B.从海水提取物质都必须通过化学反应才能实现 |
| C.粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ |
| D.“绿色化学”的核心是利用化学原理进行环境治理 |
由几种常见的盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、NO2-中的若干种离子。某同学对该溶液进行如下实验: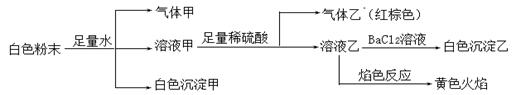
以下说法正确的是
| A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B.气体乙一定是NO和NO2的混合气体 |
| C.白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D.白色粉末中一定含有Na+、Al3+ 、NO2- |
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1 NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该试验的指示剂 |
将反应IO3- + 5I- + 6H+ 3I2 +3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
3I2 +3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是
| A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 |
| B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.两次电流计指针偏转方向相反 |