按要求书写下列化学方程式:
(1)制取TNT炸药:
(2)苯甲醛的银镜反应:
(3)合成酚醛树脂:
研究表明,火灾中绝大多数人的第一死因并非高温烘烤或火烧,而是慌乱奔跑时吸入烟雾中毒。且起火的建筑装修越豪华,这一点越明显。聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下: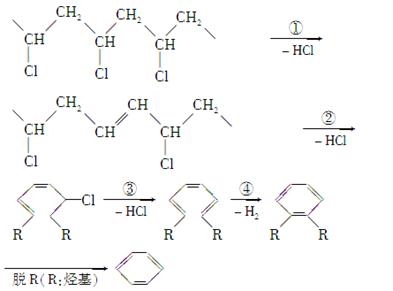
请完成下列问题:
(1)火灾中由聚氯乙烯产生的有害气体,其化学成分主要是________,你认为其中含量最大的为______________,在火灾现场,为防止气体中毒的防护措施是_____________
(2)工业上用乙烯和氯气为原料经下列各步合成聚氯乙烯PVC:
乙烯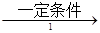 甲
甲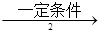 乙
乙 PVC
PVC
乙是PVC的单体,其结构简式为________,反应①、②的化学方程式分别为:
________________________、___________________________。
(3)聚氯乙烯可以制成保鲜膜,化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。聚氯乙烯(PVC)保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐(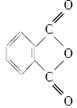 )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:_____________
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,写出制取DMP的反应方程式:_____________
聚四氟乙烯的耐热性和化学稳定性都超过其他塑料,甚至在王水中也不发生变化,故号称“塑料王”,在工业上有着广泛的用途,按照下列所示的合成路线:
(1)试在方框中填入合适的化合物的结构简式: (2)写出下列化学反应方程式:
(2)写出下列化学反应方程式:
B→C______________________________________________。
C→D______________________________________________。
在合成纤维中,涤纶、锦纶、腈纶、丙纶、维纶和氯纶被称为“六大纶”。它们都具有强度高、弹性好、耐磨、耐化学腐蚀、不发霉、不怕虫蛀、不缩水等优点,而且每一种还具有其独特的性能,它们都可以用来制作服装。已知涤纶的合成过程如框图所示:
试回答下列问题:
(1)写出下列物质的结构简式:A______________;C_____________;E________________。
(2)写出反应类型:反应①____________________;反应③__________。在反应①~⑤中,反应类型相同的是________。
(3)写出下列反应的化学方程式:
反应②___________________________________________
反应⑤____________________________________________
下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是,N的电极电极反应式为:;乙池的总反应式是,通入甲烷的铂电极上发生的电极反应式为__________________________。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;
X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: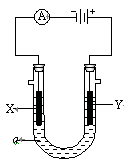
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,
则: ①X电极的材料是,电极反应式为。
②Y电极的材料是,电极反应式为。(说明:杂质发生的电极反应不必写出)