A、B、C、D、E、F六种的转化关系如右图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应。X、Y属于同一周期,且核电荷数相差4。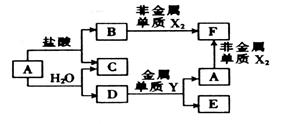
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型: ;D的化学式为 ;元素X、Y的原子半径大小顺序是 (用元素符号表示)。
(2)E与NaOH溶液反应的离子方程式为 。
(3)反应A+H2O→C+D的化学方程式为 。
(4)F能促进H2O的电离,其原因是 (用离子方程式表示)。
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH= 。
(1)食品和药品关系到人的生存和健康,现有下列五种物质:
A.亚硝酸钠B.碳酸氢钠 C.苹果汁 D.胡萝卜素E.阿司匹林
请按下列要求填空(填序号)
常可用于食品防腐的是;富含维生素C的是;用作食品色素的是;既可以用于面包的膨松剂,又可以用于治疗胃酸过多的是;可以解热镇痛的药物是。
(2)人类的生活离不开材料,
①塑料广泛应用与生产、生活的各个领域,聚乙烯塑料属于(填序号)
A.有机高分子材料 B.无机非金属材料C.金属材料
②蚕丝、尼龙、棉花这三种常见的纤维中,主要成分为蛋白质的是。
(3)我们赖以生存的地球只有一个,爱护环境人人有责
①有报道称,国家将投入50亿治理津京地区的“雾霾”。下列措施不能改善“雾霾”的是(填序号)
A.改善机动车燃油的品质
B.严格控制工厂废气的排放
C.学校遇雾霾天气停课放假
D.平时出行,多乘坐公共交通工具
②为了减少燃煤SO2的排放造成的酸雨,常采取一系列的措施,下列措施不能达到目的的是。
A.燃烧高品质的煤炭
B.用天然气代替燃煤
C.在燃煤中添加石灰石
D.加高燃煤企业的烟囱
③我国淡水资源不但短缺,而且还被大量污染,下列有关水资源的保护正确的是
A.富含氮、磷的生活污水,不需处理可以直接排放
B.电镀产生的含有重金属离子的废水,可采用高压水泵直接压入地下深层
C.轧钢厂排出含盐酸的废水,可用氢氧化钡中和处理
D.天然水中的小悬浮颗粒,可用明矾等混凝剂净化
药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下: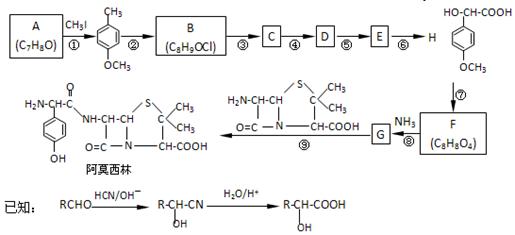
A能使三氯化铁溶液显色。完成下列填空:
(1)写出A的结构简式:_____________;CH3I的作用___________________。
(2)反应④的化学方程式____________________________________。
H的一种同分异构体的一氯代物的结构为 ,该物质在NaOH水溶液中加热反应时的化学方程式为。
,该物质在NaOH水溶液中加热反应时的化学方程式为。
(3)试写出能同时满足以下条件H所有的同分异构体。
a.能与氯化铁溶液发生显色反应
b.能与碳酸氢钠反应产生无色气泡
c.取0.1mol有机物能与足量Na反应能产生3.36L(标况下)气体
d.苯环上的一氯代物只有两种,但苯环上氢原子数不少3
e.分子中含有甲基
(4)试利用CH3CH=CH2为原料制备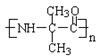 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图例如下: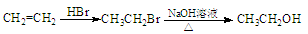
现有分子式为C10H10O2Br2的芳香族化合物X,X中苯环上有四个取代基,其中一个是酯基,苯环上的一氯代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,D和E遇FeCl3溶液显色且能与浓溴水反应。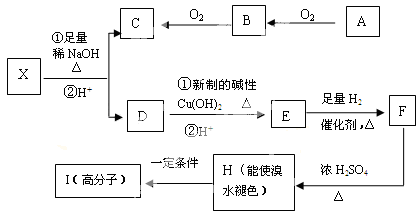
已知:
① 在稀碱溶液中,连在苯环上的溴原子不易发生水解
②两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应,如CH3CH(OH) 2 → CH3CHO + H2O
回答下列问题:
(1)H的分子式是
(2)C的结构简式为 I的结构简式为
(3)H→I反应类型是
(4)E不易发生的化学反应类型有(选填序号)
A、取代反应B、消去反应C、氧化反应 D、银镜反应
(5)下列有关D物质的叙述中正确的是(选填序号)
A、D物质能与碳酸钠反应
B、D物质苯环上有四个取代基
C、D物质有氧化性,没有还原性
D、D物质是芳香烃
(6)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:
②F→H的化学方程式:
工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 |
乙烯氧化法 |
|
| 原料 |
乙炔、水 |
乙烯、空气 |
| 反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
| 平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
| 日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 |
|
| 乙炔 |
 |
| 乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛__________________________________________________。
b.乙烯氧化法制乙醛______________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法,分析可能的原因(从环境、原料来源、能耗等角度分析,任写一点):________________________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?_________________________。
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法,理由是_____________________________。
(5)如果某工厂以乙烯为原料,通过3步可以制得聚氯乙烯,请写出合理的反应方程式(无机试剂和溶剂等任选,该过程中不发生取代反应)
_______________________________________________________
_______________________________________________________
_______________________________________________________
咖啡酸具有止血、镇咳、祛痰等疗效,其结构为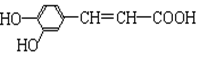
(1)咖啡酸分子中的含氧官能团的名称为、;
(2)有关咖啡酸性质的叙述错误的是;
A.在浓硫酸、加热条件下能发生消去反应
B.既能和浓溴水发生加成反应也能发生取代反应
C.能与酸性高锰酸钾溶液反应
D.1mol 咖啡酸在一定条件下能与4molH2发生加成反应
(3)有机物A(分子式为C11H12O4)在一定条件下能发生如下转化:
①D、E的结构简式分别为、;
②B→C反应的化学方程式为;
(4)R是咖啡酸的同分异构体,具有如下特点:①R具有 结构;②能发生水解反应;R的结构简式为(任写1种)。
结构;②能发生水解反应;R的结构简式为(任写1种)。