某同学在三个容积相同的密闭容器中,分别研究三种不同条件下化学反应2X(g)  Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )
Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是( )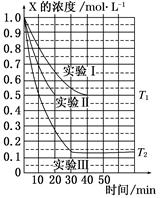
| A.与实验Ⅰ相比,实验Ⅱ可能使用了催化剂 |
| B.与实验Ⅰ相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应 |
| C.在实验Ⅰ、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同 |
| D.若起始浓度c(X)=0.8 mol·L-1,c(Y)=c(W)=0,其余条件与实验Ⅰ相同,则平衡浓度c(X)=0.4 mol·L-1 |
下列事实或现象与胶体性质无关的是
| A.煮沸的 FeCl3溶液冷却后,用一束光照射,有一条光的通路 |
| B.明矾可以用来净水 |
| C.胶态金属氧化物分散于玻璃中制成有色玻璃 |
| D.三氯化铁溶液中加入NaOH溶液出现红褐色沉淀 |
以下分类正确的是
| 单质 |
氧化物 |
酸 |
碱 |
盐 |
|
| A |
HD |
水 |
硫酸 |
烧碱 |
胆矾 |
| B |
黄铜 |
NO2 |
盐酸 |
石灰水 |
FeSO4 |
| C |
碘酒 |
一氧化碳 |
磷酸 |
NH3·H2O |
食盐 |
| D |
H2 |
Fe3O4 |
HNO3 |
纯碱 |
小苏打 |
从化学角度看,下列广告用语没有科学性错误的是
| A.“K”牌咖啡,滴滴香浓,决不含任何化学物质 |
| B.“雪山牌”矿泉水,真正的纯水 |
| C.“大自然”牌蔬菜,天然种植,不含任何元素,真正的“绿色”食品 |
| D.食用合格“碘盐”,可预防甲状腺肿大 |
下列关于有机物的说法中,正确的一组是
①米酒变酸的过程涉及了氧化反应
②除去乙酸乙酯中残留的乙酸,加过量饱和纯碱溶液振荡后,静置分液
③动植物的油脂中都含有油酸,油酸分子中含有碳碳双键,易被空气中的氧气氧化变质
④淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
⑤塑料、合成橡胶和合成纤维都是合成高分子材料
| A.①②④⑤ | B.②④⑤ | C.①②⑤ | D.③④⑤ |
下列实验的失败原因可能是因为缺少必要的实验步骤造成的是
①将乙醇和乙酸稀硫酸共热制乙酸乙酯
②无水乙醇和浓硫酸共热到140℃制乙烯
③验证RX是碘代烷,把RX与烧碱溶液混合加热后,将溶液冷却后再加入硝酸银溶液出现褐色沉淀
④做醛的还原性实验时,当加入新制的氢氧化铜悬浊液后,未出现红色沉淀
⑤检验淀粉已水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液水浴加热后未析出银镜
| A.①③④⑤ | B.③④⑤ | C.③⑤ | D.全部 |