(15分)水是生命之源,广西重金属镉污染事件是2012年1月15日发现的。水污染事件再次提醒人们保护水资源的必要性和紧迫性。工业废水中常含有一定量的Cr2O和CrO,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为:
其中第①步存在平衡:
2CrO(黄色)+2H+ Cr2O(橙色)+H2O
Cr2O(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。(填序号)
A.Cr2O和CrO的浓度相同
B.2v(Cr2O)=v(CrO)
C.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法。
该法用 Fe 做电极电解含Cr2O的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为__ __(用电极反应式解释)。
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有________。(用化学式表示)
(7)溶液中发生的总反应为(用离子方程式表示) 。
甲、乙的实验装置如图所示,丙、丁分别是氯碱工业生产示意图和制备金属钛的示意图。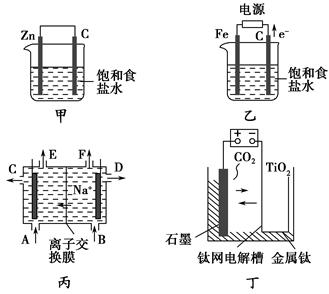
请回答下列问题:
(1)写出甲装置中碳棒表面的电极反应式:_________________________
(2)已知:5Cl2+I2+6H2O=10HCl+2HIO3。若将湿润的淀粉KI试纸置于乙装置中的碳棒附近,现象为________________________________;若乙装置中转移0.02 mol电子后停止实验,烧杯中溶液的体积为200 mL,则此时溶液的pH=________。(室温条件下,且不考虑电解产物的相互反应)
(3)工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙装置中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,Na+的移动方向如图中标注,则H2的出口是________(填“C”、“D”、“E”或“F”);________(填“能”或“不能”)将阳离子交换膜换成阴离子交换膜。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaO作电解质,利用丁装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极的电极反应式:_____________________________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)____________________________________ __。
③电解过程中需定期更换阳极材料的原因是
___________________ __________________________________________
新型锂离子电池材料Li2MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2MSiO4有两种方法。
方法一:固相法,2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。
方法二:溶胶-凝胶法,CH3COOLi、Fe(NO3)3、Si(OC2H5)4等试剂 胶体
胶体 干凝胶
干凝胶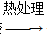 Li2FeSiO4。
Li2FeSiO4。
(1)固相法中制备Li2FeSiO4过程采用惰性气体气氛,其原因是
______________________________________________________________________。
(2)溶胶凝胶法中,检查溶液中有胶体生成的方法是________;生产中,生成1 mol Li2FeSiO4整个过程转移电子的物质的量为________mol。
(3)以Li2FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为Li+LiFeSiO4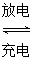 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
(4)使用(3)组装的电池必须先________。
(创新预测题)已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与
时间t的关系如图所示。
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)______c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:_____________________________________。
某温度(t ℃)时,水的离子积为KW=1.0×10-13mol2·
L-2,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是
____________________________________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是____________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: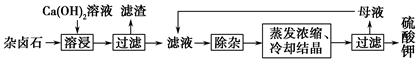
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
_____________________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。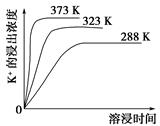
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①_______________________________________________________,
②_______________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32— CaCO3(s)+SO
CaCO3(s)+SO
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。