下列叙述或操作正确的是( )
| A.浓硫酸具有强氧化性,稀硫酸无氧化性 |
| B.浓硫酸滴到蓝矾上,蓝矾变成白色粉末,体现了浓硫酸的脱水性 |
| C.稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌 |
| D.浓硫酸与铜的反应中,浓硫酸仅表现强氧化性 |
已知反应A2(g)+2B2(g)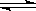 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
对可逆反应4NH3(g)+5O2(g)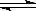 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
在2升的密闭容器中,发生以下反应:2A(g)+B(g) 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
| A.1.6 mol | B.2.8 mol | C.2.4 mol | D.1.2 mol |
下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属于新能源的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③④⑤⑥ | D.除①②外 |