人们可以对物质从不同的角度进行分类。请根据示例将酒精、醋酸、水、食盐四种物质进行分类,并写出分类依据。
| |
不同类的物质 |
分 类 依 据 |
| 示 例 |
食 盐 |
常温下食盐是固体,其余是液体 |
| 分类一 |
|
|
| 分类二 |
|
|
(14分)某兴趣小组用图1所示流程制取氧气,并回收提纯氯化钾和二氧化锰
回答下列问题:
(1)请写出制取氧气的化学方程式。在反应过程中,若收集到氧气3.2g时,其物质的量为mol。在氯酸钾和二氧化锰混合物中,此时质量分数增加的物质是,当它的质量分数不在变化的实验判断依据是。
(2)在回收提纯的过程中需要控制水的用量,原因有(填标号)。
A.提高实验效率
B.保证固体1全部溶解
C.节约能源
(3)①写出图2中仪器a、b的名称:
a,。
②步骤Ⅱ中的操作m应选择图2中(填“甲”或“乙”)装置,该操作中玻璃棒的作用是。
③步骤Ⅲ中用酸化的硝酸银(AgNO3)溶液检验洗出液中是否含有氯化钾,该检验方法的原理为(用化学方程式表示)。
(4)实验结束后,称得回收到的氯化钾的质量比理论值小,可能的原因有(写一点)。
(5)取少量烘干后二氧化锰放入盛有一定浓度过氧化氢溶液中,立刻有大量气泡产生,写出该反应的化学方程式,该反应属于反应。此反应说明二氧化锰与氯酸钾混合加热后不变的是。
(6分)现有一种无色的营养液,可能由KNO3、Ca(NO3)2、K2CO3、KCl中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。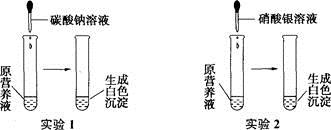
根据以上实验,请你进行有关推断。
(1)由实验l可确定原营养液中一定有的物质是,请用化学方程式表示你判断的理由,在判断原营养液中一定有的物质后,进一步可推测一定没有的物质是。
(2)根据实验1、实验2推测原营养液的组成可能有种情况。
(3)分别向实验1和实验2白色沉淀中滴加稀硝酸,有气泡产生的是,写出该反应的化学方程式。
(7分)根据所学知识,回答下列问题: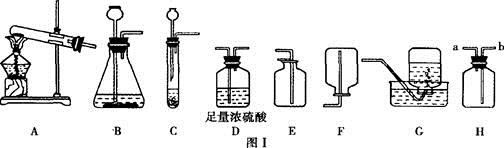
(1)实验室制取二氧化碳,从图l中可选用的发生装置是(填序号),若用H装置收集二氧化碳,则气体应从(填“a”或“b”)端通入。
(2)实验室用氯酸钾和二氧化锰的混合物制取并收集干燥的氧气时,从图甲中选用的装置依次为(填序号)。
(3)为探究二氧化碳和氢氧化钠是否发生了化学反应,某同学设计了如图Ⅱ所示实验,若该装置气密性良好,将浓氢氧化钠溶液滴入锥形瓶中,可能观察到的实验现象为。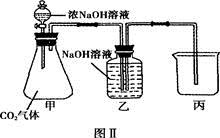
(4)实验结束后,请你通过对锥形瓶内溶液中溶质组成的探究,来推测二氧化碳与氢氧化钠是否发生了化学反应。
| 实验步骤 |
现象及结论 |
(9分)在实验室制取了两瓶常见的无色气体,放置在实验台上,如图所示。请回答下列问题: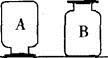
(1)A气体可能是,推断的理由是。B气体可能是(写一种)。
(2)请设计实验验证所推断的B气体,完成实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
(3)写出实验室制取B气体的化学方程式以及所需的仪器名称。
(5分) U形管中是滴有酚酞溶液的蒸馏水,向左、右两管中同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。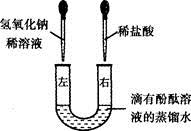
(1)开始时管溶液呈红色。
(2)充分反应后U形管中溶液全部呈无色,写出上述反应的化学方程式:。除酚酞外,此时溶液中一定含有的溶质的名称为,可能含有的溶质的化学式为,为证明是否有该物质,可在U形管中加入固体。