下列叙述正确的是
| A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- |
| B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为: c(B+)>c(OH-)>c(H+)>c(A-) |
| C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为: 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ |
| D.用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Vb<10Va |
维生素A(见下图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症。下列有关维生素A的认识不正确的是()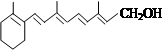
| A.维生素A的分子式为C18H26O |
| B.一定条件下,维生素A能被酸性KMnO4溶液氧化 |
| C.维生素A可使溴水褪色 |
| D.1mol维生素A分子最多可跟6 mol H2发生加成反应。 |
利用蛋白质的变性可以为我们的日常生活,医疗卫生服务。下列实例利用了蛋白质的变性的是
①利用过氧乙酸对环境、物品进行消毒;②利用高温、紫外线对医疗器械进行消毒;③蒸煮鸡蛋食用;④松花蛋的腌制;⑤用蛋白质灌服重金属中毒的病人。
| A.全部 | B.①②③④ | C.①②③ | D.①② |
苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
| A.氧化性 | B.还原性 | C.碱性 | D.酸性 |
下列关于药物的使用说法正确的是()
| A.虽然药物能治病,但大部份药物有毒副作用 |
| B.使用青霉素时,直接静脉注射可以不用进行皮肤敏感试验 |
| C.长期大量使用阿司匹林可预防疾病,没有副作用 |
| D.随着药物的普及,生病了都可以到药店自己买药吃,不用到医院 |
生活中的一些问题常涉及化学知识,下列叙述正确的是()
| A.棉花的主要成分是纤维素 |
| B.过多食用糖类物质如淀粉等不会致人发胖 |
| C.淀粉在人体内直接水解生成葡萄糖,供人体组织的营养需要 |
| D.纤维素在人体消化过程中起重要作用,纤维素可以作为人类的营养物质 |