对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
[2012·临沂一模]某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| (3) |
向(2)所得的水溶液中加入 Ba(NO3)2和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是()
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤
C.不能确定的离子是① D.不能确定的离子是③⑤
[2012·广东六校联考] 下列有关实验操作、现象和解释或结论都正确的是()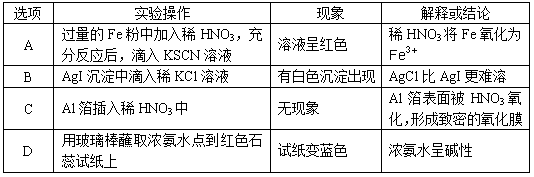
[2012·蚌埠市第二次质检]在实验中进行下列实验,括号内的实验用品都能用到的是()
| A.蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液) |
| B.溶液中Fe3+的检验(试管、氯水、KSCN溶液) |
| C.测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数(试管、酒精灯、托盘天平) |
| D.用NaOH标准溶液测定未知浓度的硫酸溶液(石蕊试液、碱式滴定管、锥形瓶) |
[2012·江苏卷] 用下列实验装置进行相应实验,能达到实验目的的是( )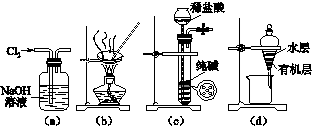
| A.用图(a)所示装置除去Cl2中含有的少量HCl |
| B.用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图(c)所示装置制取少量纯净的CO2气体 |
| D.用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
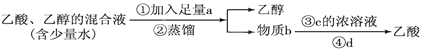
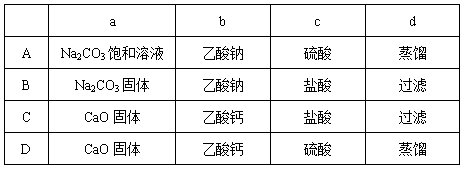
[2012·长春市第三次调研]下列四种分离乙醇、乙酸的方案中最佳的一组是()