原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是
| A.原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 |
| B.可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 |
| C.由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 |
| D.在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
如下图,铁腐蚀由快到慢的顺序为(电解质溶液为水)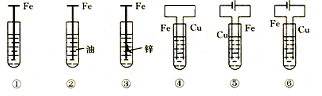
| A.⑥>④>③>②>①>⑤ | B.⑤>③>①>②>④>⑥ |
| C.⑤>④>①>②>③>⑥ | D.⑤>④>②>①>③>⑥ |
某无色透明的溶液,在PH=0和PH=14的条件下都能大量共存的是
| A.Fe2+、K+、NO3-、SO42- | B.Mg2+、NH4+、SO42-、Cl |
| C.Na+、K+、NO3-、SO42- | D.Ba2+、Na+、NO3-、SO42- |
下列哪些能说明醋酸是弱酸的事实
(1)醋酸不易腐蚀衣服
(2)0.1 mol·L-1的CH3COONa溶液的PH约为9
(3)进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多
(4)0.1 mol·L-1的CH3COOH溶液PH约为2.9
(5)相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多
(6)镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量
| A.(2)(4)(5)(6) | B.(2)(3)(5)(6) | C.(3)(4)(5)(6) | D.全是 |
密闭容器中,反应xA(g)+yB(g) zC(g)达平衡时,A的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.2 mol·L-1.下列判断正确的是
zC(g)达平衡时,A的浓度为0.5mol·L-1,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.2 mol·L-1.下列判断正确的是
| A.x+y<z | B.平衡向逆反应方向移动 |
| C.B的转化率降低 | D.C的体积分数减小 |
用铂电极分别电解KCl溶液和K 2SO4溶液时,都会出现的现象或实验结果是
2SO4溶液时,都会出现的现象或实验结果是
| A.溶液中K+离子浓度都不变 | B.溶液的pH都不变 |
C.阳极上都 生成能使湿润的碘化钾淀粉试纸变成蓝色的气体 生成能使湿润的碘化钾淀粉试纸变成蓝色的气体 |
|
| D.阴极上都生成可燃的气体 |