碳元素是构成有机物的基础元素。
(1)写出碳元素核外电子排布式 。
(2)甲烷与水分子相对分子质量差距不大但溶沸点却有很大差距,原因是 。
(3)分析甲烷、乙烯、乙炔中碳原子杂化方式 。
(4)已知CO2晶胞结构如下,已知其晶胞边长为a cm,NA表示阿伏加德罗常数,其密度为 g/cm3。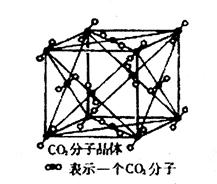
(10分)ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式: 2KClO3+SO2=2ClO2+________。
(2)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1~3。操作时,不同pH环境中粒子种类如下图所示: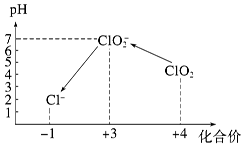
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B、丙
(2)气体甲在Cl2中燃烧的现象:;
(3)金属A与G的水溶液反应的化学方程式:;
(4)反应③的离子方程式:。
(8分)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生如下离子反应:
(1)配平:
(2)该反应常用于检验Mn2+的存在,其特征现象是___________________________________。
(3)若反应中有0.1 mol还原剂参加反应,则转移电子数为________NA,消耗氧化剂的物质的量______________mol。
A、B、C、D四种可溶性盐,知其阳离子分别是Na+、Ba2+、Cu2+、Ag+ 中的某一种,
阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种,且阴阳离子均不重复。现做以下实验:
① 将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
② 分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:
A 、B 、C 、 D 。
(2)写出实验步骤②中涉及到的所有反应的离子方程式:。
以食盐为原料进行生产并综合利用的某些过程如下图所示。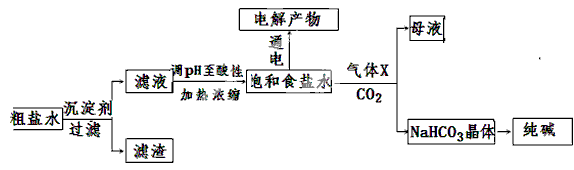
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是。
(5)下列有关NaHCO3和纯碱的说法正确的是(填字母)
| A.NaHCO3属于盐类,纯碱属于碱 |
| B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同 |
| C.常温下在水中的溶解度,NaHCO3大于纯碱 |
| D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2 |