在VL密闭容器中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2+O2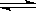 2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
| A.放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol |
| B.放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必小于amol |
| C.放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4mol |
| D.放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成石灰乳
②在海水中加入石灰乳,过滤,洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤
④在氯化氢热气流中干燥晶体
⑤电解上述晶体的熔融物。
下列说法正确的是
| A.镁元素在元素周期表中位于第4周期、第ⅡA族 |
| B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 |
| C.在氯化氢热气流中干燥晶体的目的是加快干燥速度 |
| D.步骤⑤也可以采用电解该晶体水溶液的方法 |
下列关于物质结构和化学用语的说法正确的是
| A.NH3的空间构型为三角锥形 |
| B.1个二氧化碳分子中存在2个共用电子对 |
| C.NaOH和Na2O中所含的化学键类型完全相同 |
| D.PCl5和BF3分子中所有原子的最外层都达到8电子稳定结构 |
《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是
| A.可用氧化物形式表示为BaO·CuO·2SiO2 |
| B.性质稳定,不易脱色 |
| C.易溶解于强酸和强碱 |
| D.x等于6 |
下列说法正确的是
| A.云、雾、烟都属于胶体,其分散剂都是空气 |
| B.新制氯水中的所有物质都是电解质 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D.制造光导纤维的原料是晶体硅 |
检验某未知溶液中是否含有SO42-的下列操作中最合理的是
| A.加入硝酸酸化的Ba(NO3)2溶液 |
| B.先加HNO3酸化,再加Ba(NO3)2溶液 |
| C.先加盐酸酸化,再加BaCl2溶液 |
| D.加入盐酸酸化了的BaCl2溶液 |