(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下: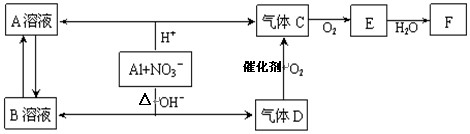
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
四种主族元素的性质或结构信息如下:
| 元素编号 |
相关信息 |
| X |
地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y |
原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z |
同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M |
能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |
(1)M的原子结构示意图是;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)(元素用元素符号表示,下同!)。
(2)Y单质溶于热浓的硫酸产生的气体的化学式为。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式:。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液E.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源(填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是。
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.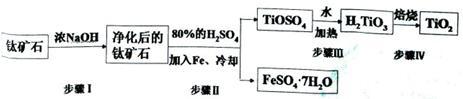
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
| A |
A的最高价氧化物对应的水化物化学式为H2AO3 |
| B |
B元素的第一电离能比同周期相邻两个元素都大 |
| C |
C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D |
Z的基态原子最外层电子排布式为3s23p2 |
| E |
E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)C在周期表中位于第 周期第 族,E基态原子核外电子排布式是
(2)A、B、D三种元素电负性由大到小排列顺序为 ,其中A的最高价氯化物构成晶体的微粒间作用力为
(3)A和B的最简单氢化物中较稳定的是 (填化学式)。B的最简单氢化物和E的黑色氧化物固体在加热时可反应,写出其反应方程式
(4)E的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出正极反应方程式
(5)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
① AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
② 2BO2(g) ⇌B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式
下表中列出五种短周期元素X、Y、Z、W、T的信息。
| 元素 |
相关信息 |
| X |
基态原子最外层电子排布为nsnnpn+1 |
| Y |
其原子L层电子数是K层3倍 |
| Z |
其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
| W |
其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
| T |
其最高正价与最低负价的代数和为6 |
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是(用离子符号表示);T元素的基态原子核外电子排布式为。
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有,晶体类型为。
(3)T元素的最高价氧化物对应水化物的化学式是H2Y的沸点比H2W高的原因是。
(4) Z2 WY3溶液呈性,其原因是(用离子方程式表示)。
(5)已知25℃、101 kPa下:
①2Z(s)+ 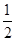 Y2(s)=Z2Y(s)△H1=-414KJ/mol
Y2(s)=Z2Y(s)△H1=-414KJ/mol
②2Z(s)+ Y2(s)=Z2Y2(s)△H1=-511KJ/mol
则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为。
镧是重要的稀土元素,应用非常广泛,如应用于压电材料、催化剂等领域。
已知:①镧是较活泼金属,在空气中易被氧化;②氢氧化镧是难溶于水的弱碱;
③
| 金属 |
熔点(℃) |
沸点(℃) |
| 钙 |
841 |
1487 |
| 镧 |
920 |
3470 |
(1)操作1、3是相同操作,其名称是。
(2)操作2中要在HCl气体的氛围内加热的原因是。
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式。
(4)真空、高温过程中的反应方程式为。
(5)粗镧精制过程中温度控制范围。
(6)重熔蒸馏制得的镧中仍然混有及少量的钙。某批次产品69.709g,经分析含钙0.209g,该产品的等级为(化工产品等级标准:优级纯≥99.8﹪,分析纯≥99.7﹪,化学纯≥99.5﹪).