一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)="4NO" (g) +CO2 (g)+2H2O (g) △H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) △H=―1160 kJ·mol一1
下列选项正确的是 ( )
| A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1 |
| B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
设NA为阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.12g石墨中含有的碳碳键数目为3 NA |
B.电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA |
C.31g P4单质中含有的P—P键个数为1.5NA |
D.1 mol FeCl3与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.定性检验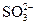 ,将BaCl2溶液用HNO3酸化 ,将BaCl2溶液用HNO3酸化 |
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化 |
C.检验溶液中是否含有Fe2+时,用硝酸酸化 |
D.检验溶液中是否有 时,在无其他离子干扰时,用盐酸酸化的BaCl2溶液 时,在无其他离子干扰时,用盐酸酸化的BaCl2溶液 |
下列事实与氢键有关的是
A.水加热到很高的温度都难以分解 |
B.水结成冰时体积膨胀,密度变小 |
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
D.HF、HCl、HBr、HI的热稳定性依次减弱 |
已知可逆反应: A+
A+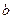 B
B cC,物质的质量分数A%和C%随温度的变化曲线如图所示,则下列说法正确的是
cC,物质的质量分数A%和C%随温度的变化曲线如图所示,则下列说法正确的是


A.该反应在T1、T3温度时达到化学平衡 |
B.该反应在T2温度时达到化学平衡 |
C.该反应的逆反应是吸热反应 |
D.升高温度,平衡向正反应方向移动 |
向含有MgCl2、AlCl3两种溶质的混合溶液中逐滴滴加7mLNaOH溶液后再逐滴滴加盐酸至不再发生化学反应,所得沉淀的物质的量Y与所加试剂的体积V之间的关系如图所示,以下结论错误的是(不考虑Mg2+、Al3+的水解)
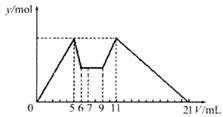



A.上述NaOH溶液和HCl溶液的物质的量浓度之比为2:1 |
B.原混合溶液中c(Al3+):c(Mg2+):c(Cl一)=1:1:5 |
C.当加入的HCl溶液的体积为4mL时,溶液中c(Na+):c(C1一)=1:2 |
D.最终得到的溶液中c(A13+):c(Mg2+):c(Cl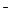 )=1:1:14 )=1:1:14 |