在某一溶液中可能含有下列几种离子:K+、Fe3+、Ag+、Ba2+、AlO2—、CO32—、SO32—、SO42—。某该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液并加热,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成分,而且各不相同。
下列说法正确的是
| A.气体甲可能为CO2或者SO2 |
| B.沉淀丙中一定含有BaCO3,可能含有BaSO4 |
| C.该溶液中肯定存在的离子有K+、AlO2—、SO32—、SO42— |
| D.只根据实验①能得出溶液中一定没有Fe3+、Ag+、Ba2+,K+是否存在无法确定。 |
毒气芥子气的结构简式为ClCH2CH2SCH2CH2Cl,下列关于芥子气的说法中,不正确的是()
| A.芥子气不是烃的衍生物 |
| B.芥子气可以在碱性溶液中发生水解反应 |
| C.芥子气可以和硝酸银溶液反应生成氯化银沉淀 |
| D.芥子气分子中只有共价单键 |
下列各组中的两个变化所发生的反应,属于同一类型的是()
| A.由甲苯制甲基环己烷;由乙烷制溴乙烷 |
| B.乙烯使溴水褪色;乙炔使高锰酸钾酸性溶液褪色 |
| C.由乙烯制聚乙烯;由1,3-丁二烯合成顺丁橡胶 |
| D.由苯制硝基苯;由乙烯制乙醇 |
2-丁烯跟溴水作用,其产物主要是()
| A.2-溴丁烷 | B.1,2-二溴丁烷 | C.2,3-二溴丁烷 | D.1,1-二溴丁烷 |
下列有机物的变化中,属于消去反应的是()
A.CH3CH2CH2OH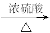 CH3CH2CH2OCH2CH2CH3+H2O CH3CH2CH2OCH2CH2CH3+H2O |
B.CH3C≡CH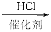 CH3CClCH2 CH3CClCH2 |
C.CH3CH2CH2Cl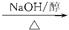 CH3CH==CH2+HCl CH3CH==CH2+HCl |
D.CH3CH2CH2Cl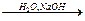 CH3CH2CH2OH+HCl CH3CH2CH2OH+HCl |
下列在一定条件下进行的反应属于水解反应的是()
①C12H22O11(麦芽糖)+H2O→2C6H12O6 ②CH2==CH2+H2O→C2H5OH
③CH3CH2Cl+H2O→CH3CH2OH+HCl ④NH3·H2O
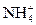 +OH-
+OH-
⑤CH3CH2ONa+H2O→CH3CH2OH+NaOH ⑥CaC2+2H2O→Ca(OH)2+C2H2↑
| A.②④ | B.①②⑤ | C.③④⑥ | D.①③⑤⑥ |