将13.6g带铁锈的铁片完全溶解于25 mL 14 mol/L热的浓H2SO4中,收集到SO2体积为1.12 L(标准状况〉。将溶液稀释至100 mL,所得溶液遇KSCN溶液时无血红色出现。下列结论正确的是
A 反应中:转移电子 个 B原混合物:
个 B原混合物:
C.反应后:剩余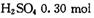 D .所得溶液:
D .所得溶液:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是()
| A.X与Y形成化合物是,X可以显负价,Y显正价 |
| B.第一电离能可能Y小于X |
| C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的 |
| D.气态氢化物的稳定性:HmY小于HmX |
下列各组物质气化或熔化时,所克服的微粒间作用力完全相同的是()
| A.碘的升华和干冰气化 | B.二氧化硅和干冰熔化 |
| C.苯和硝酸钾熔化 | D.食盐和冰熔化 |
某元素的3p能级上有两个未成对电子,因此其()
| A.第三电子层上有4个电子 | B.最高正价为+2 |
| C.最高正价为+4 | D.第二电子层没有未成对电子 |
下列说法中,正确的是
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大 |
B.AgCl悬浊液中存在平衡: AgCl(s)  Ag+(aq)+Cl―(aq),往其中加入少量 Ag+(aq)+Cl―(aq),往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
| C.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl) > Ksp(AgI) |
| D.硬水含有较多Ca2+、Mg2+、HCO3―、SO42―,加热煮沸可以完全除去其中的Ca2+、Mg2+ |
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=
1.0 mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物
的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.若增大CO浓度,K2和K1都增大 | B.K2>K1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |