(14分)巳知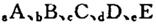 元索,
元索,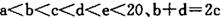 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
(1) B的原子结构示意图为_________;E在元素周期表中的位置________。
(2) 已知C2及其化合物有以下转化关系(部分物质已省略):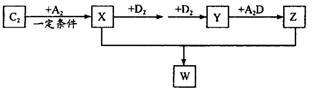
①将已收集满气体Y的试管管口倒扣在水面下,可以观察到的现象是________;其化学反应方程式为________; W的晶体类型为________;将E单质与Z的极稀溶液混合,还原产物只有W,则该反应的离子方程式为________________________。
②上述合成X的反应处于平衡状态时,气体X的浓度为C(X)(如图)。在恒温恒容条件下,t1时刻通人X将X的浓度变为2c(X)。请在下图画出平衡移动过程中X浓度的变化趋势图。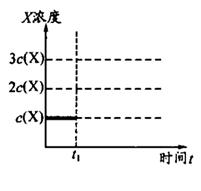
(3) 由其中三种元素形成的只含极性键、具有18电子的共价化合物为________ (写结构简式,至少2种)。
【化学--选修2化学与技术】
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: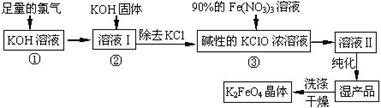
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
| A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
(6)从“反应液II”中分离出K2FeO4后,还会有副产品 (写化学式),它们都是重要的化工 产品,具体说出其中一种物质的用途 (答1点即可); 则反应③中发生的离子反应方程式为。
(7)如何判断K2FeO4晶体已经洗涤干净。
碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+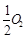 (g)=CO(g)ΔH1=-126.4kJ/mol①
(g)=CO(g)ΔH1=-126.4kJ/mol①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1②
S(s)+O2(g)=SO2(g)ΔH3= -296.8kJ·mol-1③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。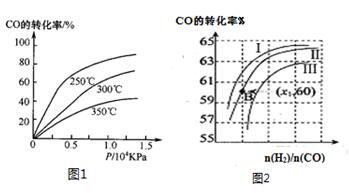
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为;测得B(X1,60)点氢气的转化率为40%,则x1=。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是(填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
E. 混合气体的密度增大
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O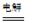 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示: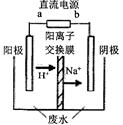
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O;。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇kg(计算结果保留2位小数)
金属钛素有“太空金属”、“未来金属”等美誉。工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下图所示。
已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼烧”所需主要仪器有。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为(用小数表示,保留二位小数)。
一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
某学生的实验过程和具体操作可简述如下:
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有,检验该离子的方法是。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将油层b转移至中,再加入足量稀 Na2SO3溶液充分振荡,静置。 |
|
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 |
溶液分层,下层呈橙红色,证明。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中,至温度计升高至450C左右。 |
馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率(用小数表示,保留二位小数)。
(1)钠镁铝三种元素中第一电离能最大的是。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3•10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
(4)部分共价键键能数据如下表:
| 键 |
H-H |
N-H |
N-N |
N=N |
N≡N |
| 键能/kJ•mol-1 |
436 |
391 |
159 |
418 |
945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式:。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
|
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式。