欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
用化学术语回答下列问题:
(1)书写电离方程式:氢氟酸 ;
(2)书写水解离子方程式:硫酸铝 ;
(3)电解硝酸银溶液电极反应式(惰性电极)①阳极: ;②阴极: .
现有室温下浓度均为1×10﹣3mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③ ⑥(填“>”、“<”或“=”).溶液中的离子浓度由大到小的顺序为 .
(2)将等体积的①、⑤混合,则溶液的pH 7(填“>”、“<”或“=”),用离子方程式说明其原因
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为 ,最终产生H2总量的关系为
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH 大小关系为① ③(填“>”、“<”或“=”)
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤ ⑥(填“>”、“<”或“=”)
CuSO4溶液是中学化学及工农业生产中常见的一种试剂.
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是 .
(2)该同学利用制得的CuSO4溶液,进行以下实验探究.
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池.电解质溶液甲是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 .
②图二中,I是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在II中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 .若把II中电极均换为惰性电极,电解时的化学反应方程式为 .若把II中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH= (假设电解后溶液体积不变).
(3)将蓝矾(CuSO4•5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4•yCu(OH)2].为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体.所得数据显示n(HCl):n(CuO)=3:2,则该碱式硫酸铜的化学式中x:y= .
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察图,然后回答问题.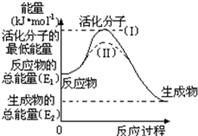
(1)已知热化学方程式:H2(g)+ O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 ;
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 ;
(2)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能 ,单位体积内活化分子的百分数 ,因此反应速率 ,你认为最可能的原因是 .
在一定温度下,把2摩SO2和1摩O2通入一个一定容积的密闭的容器里,发生如下反应:
当此反应进行到一定程度时,反应混和物就处于化学平衡状态.现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(摩).如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同.请填写下列空白:
(1)若a=0,b=0,则c= .
(2)若a=0.5,则b= 和c= .
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c): .