(14分,方程式各3分,其余每空2分)2-羟基丁二酸存在于苹果中的一种有机物,它结构简式是: 。
。
(1)2-羟基丁二酸中含有的官能团名称是 ;在一定条件下它可发生化学反应的类型有 (填序号);
| A.水解反应 | B.取代反应 | C.加成反应 | D.消去反应 E.加聚反应 F.中和反应 |
(2)下列物质与2-羟基丁二酸互为同分异构体的是 (填序号);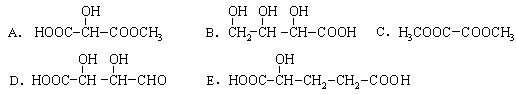
(3)写出2-羟基丁二酸与乙醇在一定条件下发生反应的化学方程式:
;
(4)2-羟基丁二酸在一定条件下可制得有机物X,X可使溴的四氯化碳溶液褪色。
写出X的结构简式 ,其化学方程式为:
“洁净煤技术”研究在世界上相当普遍,科研人员通过向煤气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达12 500~16 000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。已知:
C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1①
CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g) 2H2O(g) ΔH2=-483.6 kJ·mol-1②
2H2O(g) ΔH2=-483.6 kJ·mol-1②
C(s)+H2O(g) CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知化学键的键能为:
| 化学键 |
H—H |
N—H |
 |
| 键能/( kJ·mol-1) |
436 |
391 |
945 |
又知反应N2(g)+3H2(g) 2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为 。
2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为 。
(3)已知:C(石墨,s)+O2(g) CO2(g) ΔH="-393" kJ·mol-1
CO2(g) ΔH="-393" kJ·mol-1
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) ΔH="-2" 599 kJ·mol-1
4CO2(g)+2H2O(l) ΔH="-2" 599 kJ·mol-1
根据盖斯定律,计算298 K时C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为 。
工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为 。
按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则H2的燃烧热的ΔH= ;表示氢气燃烧的热化学方程式为 。
(2)在1.01×105 Pa时,16 g S在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S的燃烧热的ΔH= ;S燃烧的热化学方程式为 。
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1 g甲硅烷自燃放出44.6 kJ热量,其热化学方程式为 。
已知下列热化学方程式:
①CaCO3(s) CaO(s)+CO2(g) ΔH=+177.7 kJ
CaO(s)+CO2(g) ΔH=+177.7 kJ
②C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
③HCl(l)+NaOH(l) NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
④C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
⑤CO(g)+O2(g) CO2(g) ΔH="-283" kJ·mol-1
CO2(g) ΔH="-283" kJ·mol-1
⑥2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有 。
(2)上述反应中,表示燃烧热的热化学方程式有 。