下列有关反应类型说法中正确的是 ( )
A.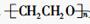 是通过加聚反应得到的产物 是通过加聚反应得到的产物 |
| B.乙醇在浓硫酸作催化剂,并且在加热的条件下一定发生消去反应 |
| C.卤代烃一般来说在NaOH的水溶液中能发生取代反应,而在NaOH的醇溶液中不一定能发生消去反应 |
| D.酯类物质在一定条件下水解一定得到相应的羧酸和醇 |
向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况。则下列叙述正确的是
| A.溶液的pH增大 | B.溶液的pH减小 |
| C.溶液中Ca2+浓度保持不变 | D.溶液中Ca2+物质的量保持不变 |
目前市场上的手提应急灯,主要是“无液干粉”铅蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是铅硫酸二氧化铅。下列关于该铅蓄电池的说法正确的是
| A.充电时电源的正极接铅蓄电池标“+”的一极 |
| B.“无液干粉”铅蓄电池彻底改变了原来的铅蓄电池的原理 |
| C.放电时在铅蓄电池的负极发生还原反应 |
| D.充电时电池上标有“-”的极发生氧化反应 |
下列说法不正确的是
| A.镀锡的铁片镀层破损后,腐蚀速率加快 |
| B.Fe在食盐水中被腐蚀,其负极反应为 O2 +2H2O + 4e- = 4OH- |
| C.可用被保护金属与直流电源负极相接的方法来减慢腐蚀速率 |
| D.电解法精炼铜时,阳极材料应用粗铜 |
温度相同,浓度均为0.2 molL-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是
| A.③①④②⑤ | B.①③⑤④② | C.③②①⑤④ | D.⑤②④①③ |
下列事实能用勒夏特列原理来解释的是
| A.由H2、I2、HI组成的平衡体系加压后颜色变深 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.使用催化剂可加快SO2转化为SO3的速率 |
| D.将木炭粉碎后与O2反应,速率更快 |