在一定温度下,下列叙述表明可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ( )
2C(气)+2D(固)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④A、B、C的百分含量不在变化
⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2
A.①③④⑤⑥⑦⑧ B.②⑤⑧ C.①③④⑤⑥⑦ D.②⑤⑥⑧
在下列给定条件的溶液中,一定能大量共存的离子组是
| A.能使酚酞变红的溶液中:AlO2-、Na+、NH4+、NO3- |
| B.25℃,由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:K+、Na+、SO42- HCO3- |
| C.常温下,在c(H+)/c(OH-)=1×10-12的溶液中:Na+、CO32-、Cl-、NO3- |
| D.在酸性KMnO4溶液中:Na+、I-、SO42-、NO3- |
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
| D.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA |
将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中,下列各项为通入CO2过程中溶液内发生反应的离子方程式,其中不正确的是:
A.a =3.36时,CO2+2OH- = CO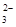 +H2O +H2O |
B.a =4.48时,2CO2+3OH- = CO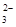 +HCO +HCO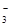 +H2O +H2O |
C.a =6.72时,CO2+OH- = HCO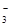 |
D.a =8.96时,3CO2+4OH- = CO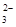 +2HCO +2HCO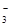 +H2O +H2O |
设NA代表阿伏加德罗常数的值,下列叙述不正确的是:
| A.标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA |
| B.常温常压下,Na2O2与足量H2O反应,共生成1molO2,转移电子的数目为2 NA |
| C.常温常压下,0.l NA个Al与足量氢氧化钠溶液反应生成的H2体积大于3.36 L |
| D.4.4g CO2所含有的成键电子数约为0.8NA |
下列离子组在指定溶液中一定能大量共存的是
| A.c(I-)=0.1 mol·L-1的溶液中: Na+、Al3+、ClO-、SO42- |
| B.0.2 mol·L-1NaHC2O4溶液中:Ca2+、Na+、OH-、Cl- |
| C.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:Ba2+、K+、NO3-、Br- |
| D.加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- |