将溶液或气体X慢慢的加入或通入到一定量的Y溶液中,Y溶液产生沉淀的量与X的物质的量的关系可以用如图表示的是 : 
| A.X为NaOH溶液,Y为AlCl3溶液 |
| B.X为CO2,Y为Ca(OH)2溶液 |
| C.X为NH3,Y为Al2(SO4)3溶液 |
| D.X为HCl,Y为Na[Al(OH)4]溶液 |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2, 因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是()
A.CO与HbO2反应的平衡常数K= |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O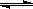 CH3COOH+C2H5OH。
CH3COOH+C2H5OH。
已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是()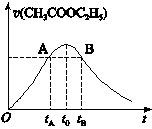
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t 0时反应达到平衡状态
D.t 0时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )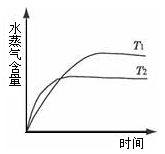
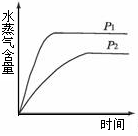
温度(T)的影响 压强(p)的影响
A.CO2(g)+2NH3(g) 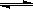 CO(NH2)2(s) + H2O(g);△H<0 CO(NH2)2(s) + H2O(g);△H<0 |
B.CO2(g)+ H2(g) 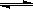 CO(g) + H2O(g);△H>0 CO(g) + H2O(g);△H>0 |
C.CH3CH2OH(g) 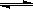 CH2=CH2(g) + H2O(g);△H>0 CH2=CH2(g) + H2O(g);△H>0 |
D.2C6H5CH2CH3(g) + O2(g )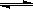 2C6H5CH=CH2(g) + 2 H2O(g);△H<0 2C6H5CH=CH2(g) + 2 H2O(g);△H<0 |
下列实验方案中不能实现:Fe+H2SO4=FeSO4+H2↑反应的是
| A.用导线将铁片和铜片连接后,放入一盛有稀 H2SO4溶液的烧杯中 |
| B.Cu片作阳极,铁片作阴极,电解一定量的H2SO4溶液 |
| C.Cu片作阴极,铁片作阳极,电解一定量的H2SO4溶液 |
| D.将铁片直接放入一盛有稀 H2SO4溶液的烧杯中 |
被称之为“软电池”的纸质电池,其电池总反应Zn+2MnO2+H2O ZnO+2MnO(OH)。下列说法正确的是 ( )
ZnO+2MnO(OH)。下列说法正确的是 ( )
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当65g Zn完全溶解时,流经电极的电子1mol |
D.电池正极反应式为MnO2+e-+H2O MnO(OH)+OH- MnO(OH)+OH- |