下列说法正确的是( )
| A.分子晶体中分子间作用力越大,则该物质越稳定 |
| B.乙醇和二甲醚互为同分异构体 |
| C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大 |
| D.任何原子的原子核都是由质子和中子构成的 |
下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾 Na(l)+KCl(l) K(g)+NaCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
| A.③④ | B.①② | C.①⑤ | D.①②⑤ |
下列说法正确的是
| A.常温常压下,只有一种元素的单质呈液态 |
| B.周期表中所有元素都有从自然界中发现的 |
| C.过渡元素不全是金属元素 |
| D.常温常压下,气态单质的分子都是由非金属元素的原子形成的 |
下列说法正确的是
| A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 |
| B.乙烷与氯气在光照条件下反应生成的有机物共有6种 |
| C.丙烯既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应 |
| D.相同物质的量的甲烷和乙烷完全燃烧甲烷耗氧量多 |
下面有关电化学的图示,完全正确的是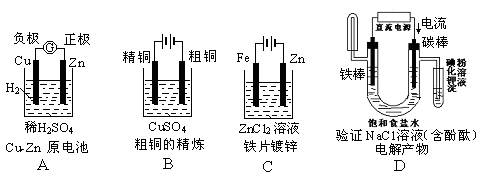
下图分别表示四种操作,其中有两个错误的是