(4分)(1)相对分子质量为70的烯烃的分子式为________;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为________。
GaAs是仅次于硅的一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第ⅤA族。
(1)Ga和As的最外层电子数分别是。
(2)GaAs中Ga和As的化合价分别是。
(3)第ⅣA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为。
新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料。它可以用超酸H(CB11H60Cl60)和C60反应,使C60得到质子来制取。该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个离子方程式)。
纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的主要原因。假设某纳米颗粒的大小和结构恰好与氯化钠晶胞(如下图所示)相同,则这种纳米颗粒的表面粒子数与总粒子数的比值为。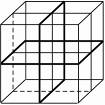
在灾难性事故中,骨折时有发生,通常用石膏来固定骨折部位。石膏可分为熟石膏(CaSO4·1/2H2O,一种白色粉末)和生石膏(CaSO4·2H2O,一种坚硬的固体)两种,医生使用的石膏是(填化学式或名称)。石膏定型时发生的化学反应方程式:。
1986年,在瑞士苏黎世工作的两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得1987年的诺贝尔物理学奖。这种超导材料的晶体结构如右图所示,其化学式为YBa2Cu3O7。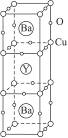
(1)已知该化合物中各元素的化合价为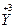 、
、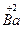 、
、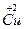 和
和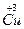 。试计算Cu在化合物中的平均化合价为______________,两种价态Cu的原子个数之比为____________。
。试计算Cu在化合物中的平均化合价为______________,两种价态Cu的原子个数之比为____________。
(2)用氧化物的形式表示该化合物的组成:____________________________________。